Princípios de Química Inorgânica e Orgânica
Aula 1
Ácidos e Bases
Ácidos e Bases
Olá, estudante! Nesta videoaula você irá conhecer os conceitos dos ácidos e bases de Arrhenius e Bronsted Lowry, assim como o sistema de nomenclatura desses compostos e as propriedades e características. Esse conteúdo é importante para sua prática profissional, pois são fundamentais na compreensão da química ácido-base. Esses conceitos são aplicáveis em diversas áreas, como na indústria química, farmacêutica e ambiental, influenciando processos de síntese, formulação de medicamentos e tratamento de efluentes. Pronto para embarcar nessa jornada de descobertas? Vamos lá!
Ponto de Partida
Estudante, a partir de agora você dará início ao estudo das funções inorgânicas, aprendendo sobre os ácidos e as bases. Para isso, você verá como são formadas essas substâncias e a maneira como se deve nomeá-las, diferenciando-as umas das outras. Estudará primeiramente os ácidos, que são substâncias que se ionizam em contato com a água liberando íons . Você verá nesse contexto, que os ácidos podem ser fracos, moderados e fortes, e que existem diversas regras para que possamos nomeá-los. Conhecerá também as bases, que são substâncias que liberam o íon (hidroxila) em contato com água. As bases também podem ser classificadas em fracas, moderadas e fortes e possuem regras para serem nomeadas. Além disso, compreenderá as características de ácidos e bases que são doadores e recebedores de espécies em reações químicas e como isso pode alterar o comportamento da solução.
Sobre o exposto, você deverá refletir sobre o solo. O solo pode apresentar características ácidas que podem prejudicar a safra, trazendo resultados ruins para o agricultor. Uma análise do solo pode ser realizada em laboratório para verificar o , porém é um procedimento oneroso.
Assim sendo, a observação das flores de hortênsia vem sendo empregada e, apesar de não ser tão rigorosa, vem apresentando bons resultados a respeito da acidez e/ou basicidade dos solos, pois essas flores apresentam coloração variável em decorrência do do solo onde estão sendo cultivadas. O índice de acidez e alcalinidade do solo pode realmente alterar a coloração dessas flores, as quais, quando crescem em solos ácidos, ou seja, com abaixo de , nascem azuis, e, em solos alcalinos, com acima de, nascem rosadas e até brancas. Mas quais são esses ácidos e bases? E como é dada a sua nomenclatura? Você deverá pesquisar quais são essas substâncias e nomeá-las. Bons estudos!
Vamos Começar!
Caro estudante, em 1884, o químico sueco Svante Arrhenius propôs que os ácidos e as bases se dissociam na água formando íons. Segundo Kotz (2010), essa teoria antecedeu qualquer conhecimento a respeito da composição e da estrutura dos átomos, não tendo sido bem aceita inicialmente. Os ácidos foram reconhecidos como substâncias que têm gosto azedo, característica esta que deu origem ao seu nome de origem latina acidus, que significava “azedo”. Além do sabor azedo, eles possuem outras características, como condutividade elétrica em solução aquosa (em água), mudança de cor de certas substâncias e reação com as bases, formando sal e água. As bases ou álcalis são compostos adstringentes, seu nome vem da palavra álcali, que possui origem do árabe al-kali e significa “cinzas de uma planta”, e assim como os ácidos, também são condutores de eletricidade.
Ácidos e bases de Arrhenius
A definição de Arrhenius para ácidos e bases centraliza-se na formação de íons e em soluções aquosas. Ele definiu os ácidos como toda substância que, quando ioniza em água, libera o cátion hidrogênio , aumentando a sua concentração na solução aquosa, como mostra a seguinte reação:
E definiu as bases como substâncias que, quando dissolvidas em água, aumentam a concentração do íon hidroxila, , na solução.
Arrhenius propôs ainda que a força do ácido estava relacionada com a extensão na qual o ácido ionizava. Alguns ácidos, como o ácido clorídrico – – e o ácido nítrico – –, ionizam completamente na água, pois eles são eletrólitos fortes, os quais agora serão por nós chamamos de ácidos fortes. Outros ácidos ionizam apenas uma fração para produzir íons e são chamados de eletrólitos fracos, ou seja, ácidos fracos. Os ácidos podem ser classificados em relação a sua volatilidade, sua estabilidade, seu grau de oxigenação, seu grau de hidratação, seu grau de ionização e quanto ao número de hidrogênios ionizáveis. O grau de ionização () é a razão entre o número de moléculas ionizadas e o número total de moléculas dissolvidas. É com base no grau de ionização que podemos classificar o ácido em fraco, moderado e forte, como mostra a Tabela 4.1.
Classificação | Grau de ionização () |
Ácidos fortes | |
Ácidos moderados | |
Ácidos fracos |
Tabela 4.1 Classificação dos ácidos conforme o grau de ionização. Fonte: FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
A reação entre um ácido e uma base produz sal e água. Uma vez que as propriedades características de um ácido são perdidas quando uma base é adicionada e vice-versa, as reações ácido-base são logicamente descritas como o resultado da combinação de e para formar água.
O ácido clorídrico e o hidróxido de sódio são eletrólitos fortes em água. As reações entre ácidos fortes e bases fortes são chamadas de reações de neutralização porque, depois de concluídas, a solução não é ácida nem básica se exatamente as mesmas quantidades de matéria do ácido e da base são misturadas. Os outros íons permanecem inalterados. Se a água é evaporada, no entanto, o cátion e o ânion formam um sal sólido. Se você misturar e , pode-se obter .
Se ácido acético e hidróxido de sódio são misturados, a seguinte reação ocorrerá:
Como o ácido acético é um ácido fraco e se ioniza em uma pequena extensão, as espécies moleculares são a forma predominante nas soluções aquosas.
A acidez e a basicidade (ou alcalinidade) de uma solução aquosa dependem da quantidade de íons e presentes na solução. A água pura contém molecular e quantidades pequenas, porém iguais, de íons e . Quando um ácido ou uma base são adicionados na água, eles produzem íons ou . Quanto mais forte for um ácido numa dada concentração, maior será a quantidade de íons na solução; o mesmo se aplica a uma base em relação aos íons em solução. Para expressarmos concentração dos íons de uma solução, utilizamos a medida do potencial hidrogeniônico ().
A escala usual de vai de 0 a 14. O ponto médio da escala, 7, representa o de uma solução neutra, como, por exemplo: água pura, que não é nem ácida nem básica porque as concentrações de íons e são iguais. Uma solução ácida tem uma concentração de íons maior do que uma solução neutra e apresenta menor do que 7, da mesma forma uma solução básica possui concentração de íons menor do que uma solução neutra e apresenta maior do que 7.
Dentro desse contexto, destacam-se os ácidos polipróticos, cujas moléculas são capazes de doar mais que um íon , pois se ionizam em várias etapas, fornecendo um íon por vez, como, por exemplo, o ácido sulfúrico () que ioniza em duas etapas liberando dois íons .
Na primeira etapa, um próton é transferido à água, produzindo um íon hidrônio e o íon hidrogenossulfato, . Na segunda etapa, que ocorre em menor extensão, o íon hidrossulfato doa seu próton remanescente à água, formando um segundo íon hidrônio e o íon sulfato.
Os ácidos podem ser classificados quanto à presença de oxigênio na fórmula. Assim, os hidrácidos são ácidos que não contém oxigênio, por exemplo: , , , , e . Já os oxiácidos são ácidos que contém oxigênio, como, por exemplo: , , e .
No caso dos hidrácidos a nomenclatura é constituída de forma bem simples. Quando o nome do ânion termina em “-eto” o nome do ácido é formado pela junção do sufixo “-ídrico” à raiz do ânion, da seguinte forma: Ácido + Raiz do ânion + Sufixo ídrico. Existe também uma tendência de nomear os hidrácidos usando a seguinte nomenclatura: nome do ânion de hidrogênio.
Para os oxiácidos, os nomes dos ânions que contém oxigênio terminam geralmente em “-ato” ou “-ito”. Para os íons que possuem os nomes que terminam com “-ato”, o nome será composto por: Ácido + Raiz do ânion + Sufixo -ico.
A todos os oxiácidos que possuem o término do seu nome em “-ico” dá-se o nome de ácido padrão. Eles são utilizados para nomear os demais oxiácidos, conforme o grau de hidratação, ou seja, se diminuirmos um oxigênio de um ácido padrão, o sufixo “-ico” será trocado pelo sufixo “-oso”. Se dois oxigênios forem subtraídos desse ácido, será adicionado o prefixo “hipo-”, e o sufixo “-ico” será trocado pelo sufixo “-oso”. E se o número de oxigênio for incrementado em um, o prefixo “per” será adicionado.
As bases podem ser classificadas com base no número de hidroxilas (), solubilidade e grau de dissociação. A classificação por meio do número de hidroxilas ocorre da seguinte forma:
Monobases: 1 ; exemplos:, , .
Dibases: 2 ; exemplos: , .
Tribases: 3 ; exemplos: , .
Tetrabases: 4 ; exemplo: , .
Considerando a solubilidade das bases, podemos classificá-las em solúveis, pouco solúveis e insolúveis. As bases formadas por metais alcalinos são solúveis – (hidróxido de lítio); as formadas por metais alcalinos terrosos são pouco solúveis – (hidróxido de cálcio); e as formadas por outros metais são praticamente insolúveis – (hidróxido de ferro). Vale destacar que essa regra é aplicada à classificação em relação à solubilidade em água.
A nomenclatura das bases é dada pela união da palavra hidróxido + o nome do cátion, como por exemplo: é formado pelo cátion (cálcio) e pelo ânion (hidroxila), portanto, o nome será hidróxido de cálcio. Existem exemplos em que um mesmo elemento químico forma cátions com valências diferentes; nesse caso o número da carga do íon é acrescentado ao final do nome ou se acrescenta o sufixo “-oso” ao íon de menor valência e “-ico” ao íon de maior valência, como, por exemplo, o ferro, que pode formar os cátions e , razão pela qual seus nomes são, respectivamente, hidróxido de ferro (II) ou hidróxido ferroso – – e hidróxido de ferro (III) ou hidróxido férrico – –.
Siga em Frente...
Ácidos e bases de Bronsted Lowry
As definições de Arrhenius para ácidos e bases apresentam uma característica fundamental, as substâncias químicas precisam possuir em sua estrutura os íons e/ou para serem classificados como ácidos e bases, respectivamente. Mas quando uma espécie química não apresenta íons e/ou em sua estrutura e mesmo assim possui capacidade de alterar o pH de uma solução, como podemos classificá-los como ácidos e bases?
Os ácidos e bases de Bronsted-Lowry são fundamentais na compreensão da química ácido-base, fornecendo uma abordagem mais abrangente e flexível em comparação com a teoria de Arrhenius. Neste texto, você vai explorar detalhes dos conceitos, exemplos e aplicações dos ácidos e bases de acordo com a teoria de Bronsted-Lowry, destacando sua importância em diversas áreas da química e além.
Os ácidos e bases de Bronsted-Lowry foram propostos por Johannes Nicolaus Bronsted e Thomas Martin Lowry em 1923. De acordo com esta teoria, um ácido é definido como qualquer substância capaz de doar prótons (íons de hidrogênio, ), enquanto uma base é qualquer substância capaz de aceitar prótons.
Em termos mais simples, um ácido de Bronsted-Lowry é uma espécie química que libera prótons em uma solução aquosa, enquanto uma base de Bronsted-Lowry é aquela que aceita prótons.
Onde temos que o ácido lático é o ácido (doa ) e a sua base conjugada (recebe ), é a base e o seu ácido conjugado.
Desse modo, temos que o ácido clorídrico () quando dissolvido em água, ele libera íons , tornando-se um ácido de acordo com a teoria de Bronsted-Lowry, assim como o ácido acético (), que libera íons em solução aquosa, doando um próton para a água.
No caso das bases, temos, como exemplo, a reação da âmonia:
Onde temos o que é a espécie que recebe um próton (), sendo, portanto, a base e o seu ácido conjugado, é o ácido e a sua base conjugada.
O hidróxido de sódio () é um exemplo de base de Bronsted-Lowry, pois ele aceita íons da água, formando íons hidroxila ().
Esses conceitos são aplicados em diversas situações, como na química orgânica, onde os ácidos de Bronsted-Lowry são amplamente utilizados na catálise de reações orgânicas, como a reação de esterificação e hidrólise de ésteres e as bases de Bronsted-Lowry são essenciais na síntese orgânica, incluindo reações de alquilação e desprotonação. Na química inorgânica, ácidos e bases de Bronsted-Lowry são usados na produção de fertilizantes, detergentes e produtos farmacêuticos.
Esses conceitos também são aplicados biologia e medicina, onde a regulação do pH é fundamental para o funcionamento adequado dos sistemas biológicos. Os ácidos e bases de Bronsted-Lowry desempenham um papel crucial na manutenção do equilíbrio ácido-base no corpo humano. Além disso, muitos medicamentos e produtos farmacêuticos são formulados usando princípios ácido-base de Bronsted-Lowry. Já na indústria alimentícia, eles são usados para controlar o pH de alimentos e bebidas, garantindo a segurança e a qualidade dos produtos.
Os ácidos e bases de Bronsted-Lowry são conceitos fundamentais na química, com aplicações em uma variedade de campos, desde a indústria até a biologia e medicina. Sua compreensão é essencial para entender os processos químicos e suas aplicações práticas. Ao compreender os princípios ácido-base de Bronsted-Lowry, os cientistas podem desenvolver novos materiais, medicamentos e tecnologias que beneficiam a sociedade como um todo.
Vamos Exercitar?
Estudante, após conhecer e compreender as características ácidos e bases, suas propriedades e características, assim como os sistemas relacionados a sua nomenclatura, é hora de aplicar esse conteúdo. Ácidos e bases desempenham papéis fundamentais na química e na vida cotidiana, influenciando processos industriais, ambientais e biológicos.
Deste modo, temos que diversos ácidos são encontrados no solo, alguns dos quais se encontram em destaque, como os ácidos oxálico, fórmico, fumárico e málico, e sua nomenclatura é apresentada na tabela 4.2.
Íon | Nomes | |||||
Ácido | Raiz do ânion | Sufixo | Resultado | Fórmula | ||
Oxalato |
| Ácido | Oxal | -ico | Ácido oxálico | |
Formiato |
| Ácido | Form | -ico | Ácido fórmico | |
Fumarato |
| Ácido | Fumar | -ico | Ácido fumárico | |
Malato | Ácido | Málico | -ico | Ácido málico | ||
Tabela 4.2 Os ácidos oxálico, fórmico, fumárico e málico e sua nomenclatura. Fonte: FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
Outros ácidos podem ser encontrados no solo, porém em quantidades menores como: os ácidos succínico, acético, aconítico, gálico, vanílico, benzoico, fumárico e chiquímico.
As bases mais encontradas no solo são os hidróxidos de amônio e cálcio e podem ser nomeadas da seguinte forma, conforme apresentado na Tabela 4.3.
Hidróxido | De | Nome do cátion | Cátion | Resultado | Fórmula |
Hidróxido | De | Amônio | Hidróxido de amônio |
| |
Hidróxido | De | Cálcio | Hidróxido de cálcio |
|
Tabela 4.3 Os hidróxidos de amônio e cálcio. Fonte: FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
Você pode precisar de informações adicionais para resolver esse problema. Continue estudando!
Saiba Mais
Para saber mais sobre os ácidos e as bases, acesse a biblioteca virtual e faça a leitura do capítulo 12, Ácidos e bases, do livro “Química”, disponível na Minha Biblioteca.
CHANG, Raymond; GOLDSBY, Kenneth A. Química. Porto Alegre: Grupo A, 2013. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788580552560/. Acesso em: 04 mar. 2024.
Para compreender e aprofundar seus conhecimentos sobre a força de ácidos e bases, faça a leitura do artigo: “Sobre a força de ácidos e bases: algumas considerações”, disponível em: https://doi.org/10.1590/S0100-40422008000600052. Acesso em: 04 mar. 2024.
Por fim, aprofunde seus conhecimentos sobre os conceitos de ácidos e bases por meio da leitura do artigo “Discutindo o contexto das definições de ácido e base”, disponível em: http://dx.doi.org/10.21577/0104-8899.20160099. Acesso em: 04 mar. 2024.
Referências Bibliográficas
CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Rio de Janeiro: Mcgraw Hill, 2013.
FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
KOTZ, John C. et al. Química geral e reações químicas. 9. ed. São Paulo: Cengage Learning, 2010, v. 1-2.
Aula 2
Sais e Óxidos
Sais e Óxidos
Olá, estudante! Nesta videoaula você irá conhecer as definições de sais, óxidos e hidretos, assim como suas propriedades, características e regras de nomenclatura. Esse conteúdo é importante para sua prática profissional, pois esses compostos influenciam processos industriais, agrícolas e farmacêuticos. Suas propriedades, como solubilidade, condutividade e reatividade, são cruciais para diversas aplicações e a nomenclatura sistemática e as características físicas ajudam na identificação e uso adequado desses compostos. Prepare-se para essa jornada de conhecimento. Vamos lá!
Ponto de Partida
Estudante, você iniciou o estudo sobre as funções inorgânicas, conhecendo não só os ácidos e as bases, como também suas diferenças, características, reações químicas e as regras de nomenclatura. Agora, vamos continuar o nosso estudo sobre as funções inorgânicas, conhecendo assim os sais, os óxidos e os hidretos. Você vai estudar primeiramente os sais e perceber o quão presentes eles estão no nosso dia a dia. Aprenderá então como eles são formados, suas características, classificação e a regra para compor a sua nomenclatura. Em seguida estudará os óxidos e de suas características, classificação e regras de nomenclatura, completando os nossos estudos sobre as funções inorgânicas. Ao final, conhecerá a função dos hidretos, suas características, propriedades e as regras de nomenclatura.
Então reflita: A corrosão pode ser definida como um processo de deterioração dos metais, representada popularmente pela maresia e pelo azinhavre. A maresia é caracterizada pela formação acelerada de ferrugem nos objetos compostos por ferro, e o azinhavre é uma camada de cor esverdeada formada nos objetos compostos por cobre ou latão. O que esses dois processos têm em comum além de serem corrosivos? Eles são acentuados nas regiões litorâneas, em razão da alta concentração de íons cloreto presentes na água do mar e na humidade do ar dessas regiões. Um exemplo clássico da formação de azinhavre é a Estátua da Liberdade, já que, tendo sido construída com a utilização de placas de cobre sobre uma estrutura de ferro e tendo sido colocada em uma região litorânea, foi sendo recoberta de azinhavre com o passar do tempo, razão pela qual possui cor esverdeada.
Nesse contexto, você deve descobrir quais são os sais presentes no azinhavre e os óxidos presentes na composição da ferrugem, bem como suas fórmulas químicas. Você também poderá apresentar medidas paliativas para minimizar da corrosão. Bons estudos!
Vamos Começar!
Caro estudante, quando um ácido e uma base reagem, formam geralmente outro produto além da água. Esse produto é chamado de sal, um composto iônico que contém um cátion diferente do íon
e um ânion diferente do íon
. O sal pode ser produzido por uma reação de neutralização que consiste em um cátion pertencente à base e de um ânion pertencente ao ácido, como, por exemplo, no sal cloreto de sódio, em que o cátion, , vem da base, , e o ânion, , vem do ácido, , e quando a solução final for evaporada, o sal, cloreto de sódio, permanecerá. A equação a seguir representa essa reação:
Os sais são derivados dos ácidos e bases. Nesse sentido, Arrhenius os definiu como substâncias que, quando adicionadas à água, liberam um cátion diferente do hidrogênio () e um ânion diferente da hidroxila (), por exemplo, nas equações para o cloreto de sódio e para o nitrato de potássio:
Os sais são substâncias bastante utilizadas em nosso cotidiano, tal como o cloreto de sódio () e o bicarbonato de sódio (), que são caracterizados pela cor branca. Porém outros sais bastante utilizados apresentam outras cores, como o sulfato cúprico (), que apresenta coloração azul e é utilizado no tratamento da água de piscinas, e o dicromato de potássio () que possui coloração vermelho-alaranjada e é utilizado no teste de bafômetro.
Os sais são compostos iônicos e se encontram em estado sólidos nas condições normais de temperatura e pressão (CNTP), possuem sabor salgado e são bons condutores de eletricidade. Alguns sais apresentam características que os permitem cristalizar em contato com a água, formando os compostos denominados de sais hidratados, como, por exemplo: (sulfato de cálcio di-hidratado) e o (cloreto de cobalto hexa-hidratado). Existem sais com características higroscópicas, ou seja, que absorvem até a umidade do ar, como é o caso do (sílica gel).
Os sais podem ser classificados de acordo com sua natureza química em: neutros, ácidos, básicos e mistos. Os sais neutros são obtidos pela reação de neutralização total, ou seja, não possuem íons e em sua composição, como, por exemplo: (cloreto de sódio), (sulfato de sódio) e o (cianeto de amônia). Os sais ácidos são obtidos por meio da reação de neutralização parcial; porém é necessário que a quantidade de ácido seja superior à de base. Em razão disso, apresentam dois cátions, sendo um metal e o outro o íon hidrogênio (). São exemplos de sais ácidos o (bicarbonato de sódio) e o (bissulfato de sódio).
Os sais básicos são obtidos a partir da reação de neutralização parcial, porém, ao contrário dos sais ácidos, a quantidade de ácido precisa ser inferior à da base, razão pela qual apresentam dois ânions, sendo um ametal e o outro o íon hidroxila , como, por exemplo, os sais (hidroxicloreto de alumínio) e o (hidroxicloreto de cálcio).
Os sais duplos ou mistos não apresentam íons hidrogênio e/ou hidroxila em sua composição, mas são formados por dois cátions diferentes de ou por dois ânions que sejam diferentes de .
A nomenclatura dos sais é composta de maneira bem simples de acordo com a seguinte regra: nome do ânion + de + nome do cátion. A Tabela 4.4 apresenta alguns exemplos.
Ânion | De | Cátion | Nome | Fórmula |
Sulfato () | de | Sódio () | Sulfato de sódio | |
Fosfato () | de | Potássio () | Fosfato de potássio | |
Acetato () | de | Magnésio () | Acetato de magnésio | |
Cloreto () | de | Cálcio () | Cloreto de cálcio | |
Nitrato () | de | Alumínio () | Nitrato de alumínio |
Tabela 4.4 Nomenclatura dos sais. Fonte: FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
Siga em Frente...
Exemplificando
Dê os nomes dos seguintes sais e classifique-os:
- : fosfato de sódio; sal neutro.
- : sulfato de sódio e lítio; sal misto.
- : sulfato de cálcio di-hidratado: sal hidratado.
- : bicarbonato de sódio, sal ácido.
Os sais ainda podem ser classificados conforme a sua solubilidade. Os sais solúveis são aqueles que se dissociam em água, sendo bons condutores de eletricidade, como os cloretos de sódio e potássio, e são classificados como insolúveis aqueles que apresentam baixa solubilidade em água, sendo assim maus condutores de eletricidade, como o cloreto e o iodeto de prata.
Dentro dos estudos sobre as funções inorgânicas, você conhecerá agora os óxidos, que são todas as substâncias formadas por oxigênio e outros elementos químicos com menor eletronegatividade do que ele. Graças à elevada afinidade eletrônica do oxigênio, os óxidos podem ser formados por metais, tendo assim um caráter mais iônico, ou por não metais, possuindo um caráter mais covalente.
Os óxidos podem ser classificados com base em sua estrutura e em seu comportamento químico. De acordo com a sua estrutura, os óxidos podem ser classificados como normais e peróxidos; quanto ao seu comportamento químico, classificam-se em: ácidos, básicos, neutros, anfóteros, mistos e peróxidos. Os óxidos ácidos são aqueles que, quando reagem com água, formam um ácido. Alguns desses óxidos podem não reagir diretamente com a água, mas reagem com uma base formando sal e água e revelando o seu comportamento ácido. São formados, geralmente, por não metais, possuindo caráter covalente, como, por exemplo: , , e .
Óxidos básicos são aqueles que, ao reagirem com a água, produzem uma base ou também são capazes de neutralizar um ácido, formando sal e água. São formados, em sua grande maioria, por metais e, portanto, possuem caráter iônico, como, por exemplo , , e . Algumas exceções, que não reagem com a água, reagem com ácidos, formando sais, caracterizando o comportamento básico, como, por exemplo: , e . Quanto à solubilidade dos óxidos, pode-se afirmar que todos são insolúveis, com a exceção dos óxidos básicos de , e .
Óxidos neutros não reagem com a água nem com os ácidos e as bases. São formados com não metais e possuem caráter covalente, são exemplos deles: , e . Os óxidos anfóteros, por sua vez, reagem tanto com ácidos fortes quanto com bases fortes, como, por exemplo: , , , e . Os óxidos duplos ou mistos são formados por dois óxidos de um mesmo elemento, como a magnetita, .
Por fim, temos os peróxidos que são óxidos que possuem dois átomos de oxigênio ligados diretamente (– O – O –) e possuem a propriedade de serem agentes oxidantes forte. O exemplo mais clássico de um peróxido é o peróxido de hidrogênio,
, conhecido popularmente como água oxigenada. Outros exemplos de peróxidos são: , , , e .
A nomenclatura dos óxidos é dada pela seguinte regra: prefixo que indica o número de átomos de oxigênio + óxido de + prefixo que indica o número de átomos do outro elemento + nome do elemento menos eletronegativo, considerando que, quando há somente um elemento menos eletronegativo, pode-se desprezar o prefixo. Os prefixos podem ser: (1) mono-; (2) di-; (3) tri-; (4) tetra-; (5) penta-; (6) hexa-; (7) hepta- e assim por diante. A Tabela 4.5 apresenta alguns exemplos do uso dessa nomenclatura.
Prefixo no de átomos de oxigênio | Óxido de | Prefixo no de átomos do outro elemento | Nome do elemento menos eletronegativo | Nome | Fórmula |
Mono | óxido de | mono | carbono | Monóxido de carbono | |
Di | óxido de | mono | enxofre | Dióxido de enxofre | |
Tri | óxido de | di | Cromo | Trióxido de dicromo | |
Pent | óxido de | di | Nitrogênio | Pentóxido de dinitrogênio |
Tabela 4.5 Nomenclatura dos óxidos. Fonte: FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
Os óxidos podem ser formados por elementos químicos que possuam diferentes valências e, neste caso, a nomenclatura dos óxidos seguirá uma nova regra, segundo a qual os prefixos serão desprezados e serão acrescentados prefixos conforme a valência do elemento, ou seja, para o elemento de menor valência será acrescentado o sufixo –oso; e para o de maior valência, o sufixo -ico, como mostra a Tabela 4.6.
Cátion | Óxido de + nome elementos menos eletronegativo + valência | Óxido de + Nome elemento menos eletronegativo + sufixo | Fórmula |
Óxido de ferro II | Óxido ferroso | ||
Óxido de ferro III | Óxido férrico | ||
Óxido de cobre I | Óxido cuproso |
| |
Óxido de cobre II | Óxido cúprico |
Tabela 4.6 Nomenclatura dos óxidos conforme a valência. Fonte: FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
Exemplificando
Dê os nomes dos seguintes óxidos e classifique-os:
- : trióxido de dialumínio; óxido anfótero.
- : óxido de bário; óxido básico.
- : pentóxido de difósforo; óxido ácido.
- : tetróxido de trichumbo; óxido misto.
Para encerrar nosso estudo sobre as funções inorgânicas, vamos trabalhar agora com os hidrtetos. Os hidretos são compostos formados pela combinação do hidrogênio com outros elementos e eles desempenham um papel significativo em várias áreas da química e correlatas, tendo propriedades distintas e diversas aplicações. Esses são compostos que contêm o hidrogênio como principal elemento. Eles podem ser classificados em três tipos principais: iônicos, covalentes e metálicos, dependendo da natureza dos elementos com os quais o hidrogênio se combina.
Os hidretos iônicos são formados pela combinação de hidrogênio com metais alcalinos e alcalino-terrosos. Eles têm uma estrutura iônica, onde o hidrogênio forma o íon hidreto (), que se une ao metal para formar o composto. Exemplos de hidretos iônicos incluem hidreto de sódio () e hidreto de lítio (). Já os hidretos covalentes resultam da combinação de hidrogênio com não-metais, formando ligações covalentes. Nesses compostos, o hidrogênio compartilha elétrons com outros elementos não metálicos. Exemplos de hidretos covalentes incluem metano (), amônia () e água (). Por fim temos os hidretos metálicos que são formados pela absorção de hidrogênio por metais, geralmente de transição. O hidrogênio ocupa os espaços intersticiais na estrutura cristalina dos metais, formando uma solução sólida. Exemplos de hidretos metálicos incluem hidreto de ferro () e hidreto de titânio ().
Os hidretos são compostos que apresentam propriedades que variam de acordo com o tipo de ligação química presente no composto. Desse modo, temos que os hidretos iônicos tendem a ser sólidos cristalinos, enquanto os hidretos covalentes podem ser líquidos ou gasosos, dependendo das condições de temperatura e pressão. Já os hidretos metálicos exibem uma ampla gama de propriedades, dependendo do metal de base e da quantidade de hidrogênio absorvida.
Quanto a nomenclatura dos hidretos, devemos seguir algumas regras específicas, dependendo do tipo de composto. Para os hidretos iônicos, a nomenclatura segue o padrão "hidreto de [nome do metal]", como hidreto de sódio (). Para os hidretos covalentes, o hidrogênio é frequentemente mencionado como um prefixo no nome do composto, como no caso do metano () e amônia (). Já os hidretos metálicos podem ser nomeados de acordo com o metal de base e a proporção de hidrogênio no composto.
Essas substâncias apresentam uma variedade de aplicações em diferentes áreas da ciência e da tecnologia. Os hidretos iônicos são utilizados como fontes de hidrogênio em reações químicas, enquanto os hidretos covalentes são essenciais em processos industriais, como a produção de amônia para fertilizantes agrícolas. Quanto aos hidretos metálicos, eles são usados como materiais de armazenamento de hidrogênio em tecnologias de células de combustível e em aplicações de armazenamento de energia.
Os hidretos são compostos químicos importantes com uma variedade de propriedades e aplicações. Sua diversidade de tipos e características os torna essenciais em muitos campos da ciência e da tecnologia, desde a química básica até aplicações avançadas em energia e materiais.
Vamos Exercitar?
Estudante, nesta aula você trabalhou com os sais, os óxidos e os hidretos, observando suas propriedades, características e nomenclatura. Os sais desempenham papéis cruciais em diversas áreas, desde a agricultura até a indústria e a medicina. Os sais são fundamentais na produção de fertilizantes, na regulação do do solo e na fabricação de produtos químicos. Os óxidos são empregados em processos de produção de materiais, na síntese de compostos orgânicos e na purificação de água. Sua aplicabilidade abrange desde a fabricação de vidros e cerâmicas até a produção de medicamentos e catalisadores, destacando sua importância na vida cotidiana e na prática profissional. Já os hidretos apresentam propriedades únicas, como capacidade de armazenamento de hidrogênio e reatividade química, possibilitam aplicações em tecnologias emergentes, como células de combustível, armazenamento de energia e catálise. Esses compostos desempenham um papel fundamental na busca por soluções sustentáveis e inovadoras para desafios contemporâneos.
Pensando no exposto, temos estudo voltado a compreensão de processos de corrosão. Deste modo, temos que o azinhavre é composto por uma mistura tóxica de hidróxido de cobre I, hidróxido de cobre II, carbonato de cobre I e carbonato de cobre II, portanto, uma mistura de bases e sais, sendo os sais o carbonato de cobre I e carbonato de cobre II, os quais possuem as seguintes fórmulas químicas:
Carbonato de cobre I ou carbonato cuproso: .
Carbonato de cobre II ou carbonato cúprico: .
Já a ferrugem tem uma composição química complexa, porém, basicamente, é constituída por óxido-hidróxido de ferro, óxido de ferro II e óxido de ferro III, os quais apresentam as seguintes fórmulas químicas:
Óxido-hidróxido de Ferro: .
Óxido de ferro III ou óxido férrico: .
Óxido de ferro II ou óxido ferroso:.
Como medidas paliativas para a ferrugem, é aconselhável que, quando possível, se mantenham as peças de ferro longe do mar, caso não seja possível mantê-las cobertas e em local refrigerado. Já para prevenir o azinhavre, é recomendado cobrir as peças de cobre com resina para que não fiquem com contato direto com a atmosfera da região litorânea, embora essa seja uma medida preventiva, que não torna, portanto, a peça inume ao azinhavre. Outras informações podem ser necessárias para compreender melhor os sais e os óxidos. Continue estudando!
Saiba Mais
Para saber mais sobre as propriedades e características dos sais e dos óxidos, acesse a biblioteca virtual e faça a leitura do capítulo 4 “Funções inorgânicas” do livro “Química”, disponível na Biblioteca Virtual 3.0.
SPIER, Vivian Cristina. Fundamentos de química. Curitiba, PR: Intersaberes, 2023. E-book. Disponível em: https://plataforma.bvirtual.com.br. Acesso em: 05 mar. 2024.
Para compreender e aprofundar seus conhecimentos sobre a solubilidade de sais inorgânicos em diferentes solventes, faça a leitura do texto: “Estudo da solubilidade de sais em misturas solventes”, disponível em: https://www.researchgate.net/profile/Lucas-Freitas-3/publication/328716320_Estudo_da_solubilidade_de_sais_inorganicos_em_misturas_de_solventes/links/5d2109de458515c11c18d1c0/Estudo-da-solubilidade-de-sais-inorganicos-em-misturas-de-solventes.pdf. Acesso em: 05 mar. 2024.
Por fim, aprofunde seus conhecimentos sobre a aplicabilidade dos óxidos por meio da leitura do artigo “Óxidos de ferro e suas aplicações em processos catalíticos: uma revisão”, disponível em: https://doi.org/10.1590/S0100-40422013000100022. Acesso em: 05 mar. 2024.
Referências Bibliográficas
CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Rio de Janeiro: Mcgraw Hill, 2013.
FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
Aula 3
Hidrocarbonetos e Compostos Aromáticos
Hidrocarbonetos e compostos aromáticos
Olá, estudante! Nesta videoaula você irá conhecer o universo da química orgânica, abordando inicialmente a estrutura e as propriedades dos compostos de carbono. Na sequência irá conhecer os hidrocarbonetos. Esse conteúdo é importante para sua prática profissional, pois desempenham papéis fundamentais em diversas áreas profissionais, como na indústria farmacêutica, de alimentos, petroquímica, entre outras. Eles são essenciais na síntese de medicamentos, na produção de plásticos, combustíveis, solventes e cosméticos, demonstrando sua ampla aplicabilidade na prática profissional. Prepare-se para essa jornada de conhecimento. Vamos lá!
Ponto de Partida
Estudante, você iniciou o estudo sobre as funções inorgânicas, conhecendo não só os ácidos, as bases, os sais, os óxidos e os hidretos como também suas diferenças, características, e as regras de nomenclatura. Agora, vamos continuar o nosso estudo sobre a química orgânica e as funções orgânicas. Primeiramente você compreenderá o conceito de química orgânica e conhecerá as características que o átomo de carbono orgânica precisa apresentar para formar essa classe de compostos. Além disso, você conhecerá os processos de hibridização do átomo de carbono presente nas moléculas orgânicas. Após conhecer esses princípios básicos, você irá trabalhar com a classificação do carbono e com a classificação das cadeias de átomos de carbono. Ao final, conhecerá a função dos hidrocarbonetos, assim como suas características gerais e suas propriedades.
Para aplicar esse conhecimento, reflita sobre a seguinte situação: você é um profissional que trabalha em uma fábrica de motores e está desenvolvendo um novo motor bastante potente, com elevada compressão. Sua tarefa é avaliar quais compostos e misturas de combustíveis podem ser utilizados neste motor. Desse modo você precisará responder a alguns questionamentos. Como avaliar hidrocarbonetos utilizados como solventes? Todos os hidrocarbonetos queimam na presença de oxigênio e por isso são utilizados como combustíveis, porém, qualquer hidrocarboneto pode ser utilizado como combustível? Bons estudos!
Vamos Começar!
Caro estudante, a química orgânica consiste no estudo das moléculas compostas por carbono. Esta definição de August Kekulé (1829 - 1896) nem sempre descreveu este ramo da química. No final do século XVIII e início do século XIX, acreditava-se que compostos orgânicos deveriam ser obtidos apenas por organismos vivos, o que ficou conhecido como Teoria do vitalismo. A síntese da ureia por Friedich Wöhler, em 1828, foi um marco para que este pensamento se transformasse.
Um dos fundamentos da química orgânica também foi desenvolvido por Kekulé. Publicações em paralelo com Couper e Butkerov ficaram conhecidas como Teoria estrutural da química orgânica. Esta teoria diz que:
- Nos compostos orgânicos, átomos tendem a formar um número fixo de ligações, carbono realiza quatro ligações, oxigênio duas, hidrogênio e cloro, uma ligação.
- Um átomo de carbono pode usar um ou mais elétrons de sua camada de valência para formar ligações com outros átomos de carbono.
De maneira geral, moléculas orgânicas são compostos formados por ligações covalentes, combinando átomos de carbono com outros elementos, como hidrogênio, oxigênio, nitrogênio, enxofre etc. Compostos formados apenas por carbonos e hidrogênios são chamados de hidrocarbonetos, sendo que a presença de diferentes elementos químicos leva a diferentes funções químicas, por exemplo, moléculas contendo grupos são chamadas de álcoois, éteres, ou ácidos carboxílicos.
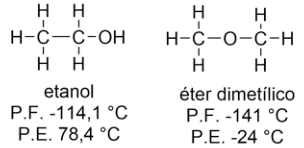
A fórmula elementar de um composto orgânico corresponde à menor proporção entre os átomos que descrevem a molécula. Você deve ficar atento que uma mesma fórmula molecular pode descrever dois compostos diferentes, como
que descreve o etanol ou o éter dimetílico, conforme apresentado na Figura 4.1. Por levarem a funções orgânicas diferentes, estes compostos apresentam propriedades diferentes, sendo chamados de isômeros constitucionais, neste caso de função.
Os átomos tendem a se ligar covalentemente para completar esta última camada, embora ocorram algumas exceções à regra do octeto. Note que quando mostramos a Teoria estrutural para o carbono, independentemente de ligações simples, duplas ou triplas, sempre quatro ligações são possíveis. Vamos analisar o hidrocarboneto mais simples, o metano. Ele é composto por um átomo de carbono e quatro átomos de hidrogênio. Em 1874, trabalhos independentes de Van’t Hoff e Le Bel descreveram o metano como uma molécula em que os hidrogênios ocupam vértices de um tetraedro, estando o átomo de carbono no centro. Desse modo, é possível observar que os átomos ocupam posições diferentes no espaço e outra que as quatro ligações com os átomos de hidrogênio são idênticas. Você se lembra que a distribuição eletrônica do carbono é e que cada ligação covalente é formada pelo compartilhamento de um elétron do carbono com um elétron do outro átomo envolvido na ligação? Como pode o carbono fazer então quatro ligações? Uma explicação para isso ser possível é realizar uma mistura de orbitais, chamada hibridização. Para o metano, esta hibridização ocorre ao se misturar o orbital com os três orbitais . O número de orbitais formados deve ser a soma dos orbitais envolvidos, quatro orbitais híbridos. Eles terão um formato entre o esférico do orbital e o formato de haltere do orbital . Estes quatro orbitais são chamados , conforme apresentado na Figura 4.2.
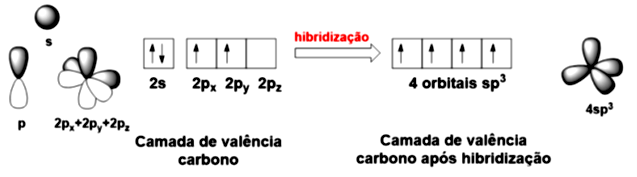
Se você considerar que a camada de valência do carbono no metano possui quatro orbitais , cada um terá um elétron (Figura 4.2), realizando quatro ligações iguais. Isso explica o metano possuir estrutura tetraédrica, com as quatro ligações idênticas em tamanho e características.
Agora, vamos analisar outra estrutura de um hidrocarboneto, o eteno, de fórmula molecular . O eteno (ou etileno) possui dois carbonos com geometria trigonal plana ligados por uma ligação dupla, sendo cada um deles ligado a dois hidrogênios. Você já se perguntou como ocorre a formação da ligação dupla? Esta ligação é composta pelo que chamamos de ligação sigma () e outra ligação pi (). No que estas ligações diferem? Para respondermos a estas questões, precisamos ver um segundo tipo de hibridização, a hibridização . Nesta hibridização, o átomo de carbono forma orbitais híbridos utilizando o orbital e apenas dois orbitais , conforme apresentado na Figura 4.3. O formato dos três orbitais formados é mais cilíndrico do que os orbitais , atribuímos isso ao fato de que temos uma contribuição maior do orbital neste caso (, enquanto para é 25%). Esta contribuição é chamada de caráter e quanto maior seu valor, mais esférico o orbital híbrido formado.
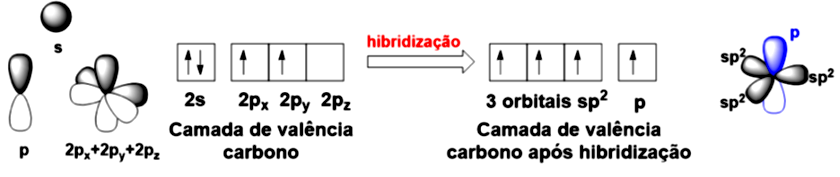
Se você observar o carbono com a hibridização , verá que um orbital permanece intacto. Ao ligar dois carbonos , teremos uma sobreposição de orbitais perfeita, caracterizando a ligação , enquanto os orbitais ficaram em paralelo, realizando uma ligação ao se sobrepor lateralmente. Com relação ao tamanho de uma ligação , devido ao tamanho do orbital (maior caráter ) ela será menor que uma ligação .
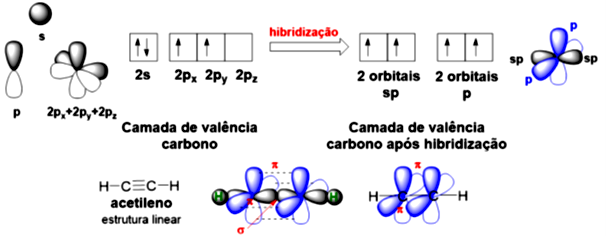
E se aumentarmos ainda mais o caráter em um orbital híbrido? Isso é o que ocorre na hibridização , em que o caráter é de
. Esta hibridização envolve apenas um orbital e um orbital , conforme mostrado na Figura 4.4. Isto é o que ocorre no acetileno (etino), um hidrocarboneto que possui uma ligação e duas ligações , possuindo assim uma ligação tripla. Este orbital é menor que os orbitais e , sendo assim, a ligação é menor entre as três ligações dos hidrocarbonetos.
Siga em Frente...
Classificação do carbono e das cadeias carbônicas
O átomo de carbono é classificado com base no número de átomos de carbono aos quais está ligado diretamente. Quando ele está ligado a quatro outros átomos de carbono, ele é chamado de quaternário. Se ele está ligado a três outros átomos de carbono, ele é denominado carbono terciário. Quando ele se liga a dois outros átomos de carbono, ele é chamado de carbono secundário, e quando ele está ligado a apenas um átomo de carbono ou a nenhum outro átomo de carbono, ele é chamado de carbono primário. Essas classificações são fundamentais na determinação das propriedades, reatividades e na organização de estruturas das moléculas orgânicas.
Quanto as cadeias dos átomos de carbono, elas representam a estrutura das moléculas orgânicas. Existem diferentes formas de classificação das cadeias carbônicas, que podem ser classificadas de acordo com as ligações presentes, número de ligações entre os átomos de carbono e presença de heteroátomos entre átomos de carbono.
A seguir você conhecerá as diferentes formas de classificação das cadeias com seus respectivos exemplos.
- Em relação a abertura e fechamento das cadeias carbônicas, elas podem ser classificadas como cadeia aberta, fechada e mista.
Cadeia aberta: apresenta pelo menos duas extremidades e nenhuma estrutura fechada.
Cadeia fechada: não possui nenhuma extremidade e uma estrutura fechada.
Cadeia mista: possui uma estrutura fechada e pelo menos uma extremidade. - Em relação a forma como os átomos de carbono estão distribuídos pela estrutura, podendo a cadeia ser normal ou ramificada.
Cadeia normal: apresenta apenas duas extremidades em uma cadeia aberta e nenhuma extremidade quando cadeia fechada.
Cadeia ramificada: Possui no mínimo três extremidades quando cadeia aberta e pelo menos uma extremidade quando cadeia fechada. - Em relação a presença de ligações simples e ligações duplas ou triplas, podendo a cadeia ser saturada ou insaturada.
Cadeia saturada: apresenta apenas átomos de carbono contendo ligações simples.
Cadeia insaturada: apresenta pelo menos uma ligação entre átomos de carbono, dupla ou tripla. - Em relação a presença de heteroátomos entre os átomos de carbono, podendo ser cadeia homogênea e heterogênea.
Cadeia homogênea: apresenta apenas átomos de carbono na cadeia principal.
Cadeia heterogênea: apresenta um heteroátomo (O, N, S) ligado a dois átomos de carbono.
Hidrocarbonetos
Os hidrocarbonetos são classificados de acordo com suas ligações em alcanos, alcenos, alcinos e aromáticos. Os alcanos apresentam fórmula estrutural , possuem apenas ligações simples e cada carbono é tetraédrico (), ligado a carbonos ou hidrogênios. A principal fonte de hidrocarbonetos é o petróleo, sendo que a gasolina e a querosene são misturas de hidrocarbonetos. Quando puros, estes compostos são incolores, com odores desagradáveis e insolúveis em água (devido à baixa polaridade). Todos os hidrocarbonetos queimam na presença de oxigênio e, por isso, são utilizados como combustíveis. Além da reação de combustão, hidrocarbonetos são pouco reativos.
Com relação ao seu estado físico, compostos com até quatro carbonos são gases na temperatura ambiente, enquanto compostos com e o heptadecano a . Hidrocarbonetos acima deste tamanho são sólidos na temperatura ambiente.
Quando temos outras cadeias carbônicas substituindo um dos átomos de em um , chamamos de cadeia ramificada. Na Figura 4.5 vemos que a fórmula pode representar o para denotar que a cadeia é linear) ou o 2-metil-butano, estes também são chamados de isômeros constitucionais, neste caso de cadeia. Note que a maior cadeia carbônica é responsável por dar o nome ao hidrocarboneto (butano), a posição do substituinte é dada pelo número 2, o nome do substituinte é metila, sendo esta estrutura ramificada.
Os alcanos podem ainda ser cíclicos, ou seja, formando um anel. A fórmula é um anel de átomos de carbono substituído com dois hidrogênios cada um, sendo denominado ciclopentano. Já a fórmula é do cicloexano, um cicloalcano bastante conhecido e estudado.
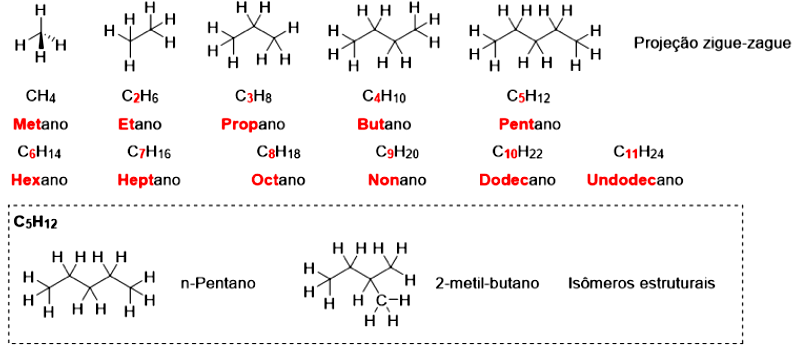
Os alcenos e alcinos possuem instaurações na forma de ligações duplas e triplas, respectivamente. Os alcenos possuem fórmula estrutural , nomeados com o sufixo “eno”. Os mais simples são o eteno e o propileno, a partir daí, devemos indicar a posição da ligação dupla, pois ela afeta as propriedades destes compostos (pontos de fusão e ebulição, solubilidade etc.). Os alcinos possuem fórmula estrutural e são nomeados com o sufixo “ino”, sendo mais simples o etino. A Figura 4.6 apresenta exemplos de alcenos e alcinos.
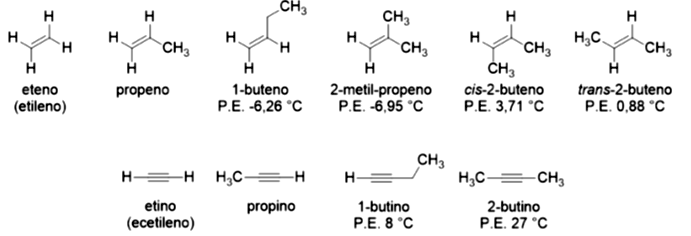
Os alcanos, os alcenos e os alcinos são incolores, sendo que os de baixo peso molecular são gases e os de peso mais elevados são líquidos e sólidos. Eles reagem com oxigênio em reações de combustão. Contudo, existe uma diferença entre eles e os alcanos: sua reatividade. A ligação não é tão forte como a ligação . Na ligação ocorre a sobreposição de orbitais, enquanto na ligação ocorre uma interação lateral. Com isso, a dupla ligação pode reagir com diversos compostos, precisando de menos energia para ser quebrada do que a ligação simples.
No entanto, existe uma classe especial de hidrocarbonetos, que embora sejam representados com duplas ligações, não apresentam a mesma reatividade de alcenos. Estes compostos são denominados compostos aromáticos. O mais simples é o benzeno, de fórmula
, e quando substituído com uma metila é nomeado tolueno. Note que estes compostos possuem uma nomenclatura bem própria, conforme apresentado na Figura 4.7.
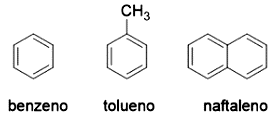
Descoberto em 1825 como subproduto de gás de iluminação, o benzeno chamou a atenção dos químicos da época. Inicialmente descrito por Kekulé como um alceno cíclico com ligações duplas e simples alternadas, em que as duas possíveis estruturas estavam em equilíbrio. Entretanto, o benzeno não se comportava como um alceno típico, já que não reagia da mesma forma. Este problema foi solucionado pela elaboração da hipótese de que o benzeno é um híbrido de duas estruturas de ressonância. De fato, passado algum tempo, com técnicas mais modernas, foi observado que o tamanho das seis ligações do anel benzênico era igual para todos,, valor entre o comprimento de ligações simples () e duplas (). Em termos de orbitais, esta estabilidade diferenciada do benzeno pode ser explicada pelo fato de que todos os orbitais das duplas ligações estão alinhados, permitindo que os elétrons circulem entre eles.
O benzeno é um líquido incolor, sendo que quando substituído pode ser líquido ou sólido (isso nas condições normais de temperatura e pressão). Comporta-se como hidrocarboneto em questão de solubilidade, ou seja, insolúveis em água e solúveis em solventes apolares. São quimicamente estáveis, não reagem como os outros compostos com ligações duplas e triplas. Esta estabilização adicional é atribuída ao efeito de ressonância, uma maneira que ela pode ser avaliada é analisando quanto de energia é liberada pela hidrogenação do benzeno e quanto de energia é liberada pela hidrogenação de três ligações duplas que estiverem isoladas. A reação de hidrogenação consiste em adicionar gás hidrogênio () a ligações duplas e triplas, levando a compostos mais saturados ou com menor número de instaurações. Quanto menos energia é liberada neste processo, mais estável é o composto que está sendo hidrogenado.
Vamos Exercitar?
Estudante, nesta aula você trabalhou com os princípios da química orgânica. Seu estudo se iniciou pelas definições de química orgânica e características do átomo de carbono. Nesse sentido, você estudou as estruturas de hibridização do carbono e as características e estruturas das cadeias orgânicas, além de verificar a classificação dos átomos de carbono em compostos orgânicos. Além disso, você conheceu e compreendeu as estruturas dos hidrocarbonetos, verificando as características e propriedades de alcanos, alcenos, alcinos e hidrocarbonetos aromáticos.
Desse modo, vamos retomar a situação envolvendo o desenvolvimento de motores, voltando nosso estudo a escolha de hidrocarbonetos e misturas de hidrocarbonetos que podem ser empregados como combustíveis. Os compostos que são utilizados como combustíveis, além de reagirem com oxigênio sofrendo combustão, devem também, não sofrer detonação facilmente. Detonação é um processo em que a energia liberada no local de início de reação se propaga na forma de uma onda de choque. Um padrão utilizado para isso é o índice de octanagem, que nada mais é do que o índice de resistência à detonação. Se uma gasolina possui octanagem 85%, corresponde à mesma resistência de detonação de uma mistura 85% de isoctano (2,2,4-trimetil-pentano) e 15% de heptano. Uma octanagem de 120% corresponde a uma resistência à detonação 20% superior ao isoctano. Quanto mais potente o motor, mais compressões ele exigirá, portanto, mais resistente à ignição espontânea o combustível deverá ser.
Baseado em seus conhecimentos de hidrocarbonetos, você sabe que eles reagem com oxigênio, por isso podem servir como combustíveis. Você verificou, então, diferentes misturas de hidrocarbonetos e testou seus índices de octanagem, obtendo valores de 75%, 98%, 107% e 117%. Baseado nestes dados, você sugere iniciar os testes com o combustível com 117% de índice de octanagem, pois o motor a ser desenvolvido utiliza alta compressão.
Outras informações podem ser necessárias para compreender melhor os compostos orgânicos e os hidrocarbonetos. Continue estudando!
Saiba Mais
Para saber mais sobre as os princípios gerais da química orgânica e a função dos hidrocarbonetos, acesse a biblioteca virtual e faça a leitura do capítulo 11 “Química Orgânica” do livro “Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente”, disponível na Minha Biblioteca.
ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. Porto Alegre: Grupo A, 2018. Disponível em: <https://integrada.minhabiblioteca.com.br/#/books/9788582604625/>. Acesso em: 09 mar. 2024.
Para compreender e aprofundar seus conhecimentos a nomenclatura de compostos orgânicos, faça a leitura do artigo: “Nomenclatura de compostos orgânicos segundo as recomendações da IUPAC. Uma breve introdução”, disponível em: https://econtents.bc.unicamp.br/inpec/index.php/chemkeys/article/view/9658/5071. Acesso em: 09 mar. 2024.
Por fim, aprofunde seus conhecimentos sobre compostos aromáticos por meio da leitura do texto “Introdução à química orgânica”, disponível em: https://atividadesescolaresprontas.com.br/wp-content/uploads/2021/10/APOSTILA-_-introducao_quimica_organica.pdf. Acesso em: 09 mar. 2024.
Referências Bibliográficas
ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. Porto Alegre: Grupo A, 2018.
CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Rio de Janeiro: Mcgraw Hill, 2013.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017.
Aula 4
Grupos Funcionais
Grupos Funcionais
Olá, estudante! Nesta videoaula você irá conhecer as funções orgânicas oxigenadas e as funções orgânicas nitrogenadas. Esse conteúdo é importante para sua prática profissional, pois essas funções estão presentes em uma variedade de compostos, desde solventes e reagentes até produtos farmacêuticos e materiais poliméricos. Compreender suas propriedades e reatividades é fundamental para diversas áreas, incluindo indústria farmacêutica, química de materiais e pesquisa científica. Prepare-se para essa jornada de conhecimento. Vamos lá!
Ponto de Partida
Caro estudante, como as funções orgânicas oxigenadas, como álcoois e cetonas, contribui para a diversidade estrutural e funcional dos compostos orgânicos encontrados na natureza e na indústria? Além disso, quais são as propriedades e aplicações dos ácidos carboxílicos e seus derivados, tais como ésteres e amidas, em diferentes áreas, como na produção de alimentos, na fabricação de polímeros e na síntese de medicamentos? Outro ponto é saber qual é o papel das funções orgânicas nitrogenadas, como aminas e amidas, na química orgânica e na bioquímica, considerando suas propriedades ácidas e básicas, bem como suas aplicações em compostos naturais e sintéticos?
Nesta aula você vai explorar o universo das funções orgânicas, abordando as funções oxigenadas, que são aquelas que apresentam um heteroátomo de oxigênio em sua composição. Dentro deste universo temos os ácidos carboxílicos, que são compostos orgânicos que possuem o grupo funcional carboxila em sua estrutura. Seus derivados incluem ésteres, amidas e anidridos, com aplicações na indústria farmacêutica, alimentícia e de polímeros. Por fim, você conhecerá as características das funções nitrogenadas, que são aquelas que possuem um heteroátomo de nitrogênio em sua constituição.
Para compreender todos esses pontos, pense na seguinte situação, você é um profissional que trabalha em um laboratório de obtenção de moléculas orgânicas aplicadas em indústria alimentícia, em que um novo adoçante está sendo avaliado para uso em suco de limão. Um dos testes que devem ser realizados é a estabilidade química, em que as funções orgânicas devem permanecer sem reagir. Quando a molécula tem sua estrutura alterada, suas propriedades organolépticas podem ser afetadas, por isso sua estabilidade é importante. Como este adoçante apresenta em sua estrutura uma função éter e o meio é suco de limão (ácido cítrico está presente), a estabilidade desta função deve ser avaliada no meio. Uma informação importante é que éteres, em meio ácido, levam à formação de álcoois. Como você poderia monitorar um experimento contendo o adoçante e o ácido cítrico na mesma concentração que o suco? Bons estudos!
Vamos Começar!
Caro estudante, as moléculas orgânicas apresentam propriedades físicas e reatividade de acordo com suas estruturas e os átomos que as compõem. A reatividade diz respeito ao comportamento químico da molécula, em outras palavras, a reatividade define frente a que tipo de reagentes a molécula original leva a produtos, além de quais os produtos formados. As propriedades dizem respeito ao seu comportamento físico-químico, como ponto de ebulição, ponto de fusão, polaridade, solubilidade etc. Os alcanos são pouco reativos, o que varia para alcenos e alcinos, devido à ligação dupla. Podemos inferir que as propriedades variam devido a estes fatores, pois alterar a hibridização afeta o formato da molécula e, portanto, suas interações intermoleculares.
Quando começamos a estudar moléculas orgânicas com diferentes átomos, vemos que estas propriedades variam muito. Por exemplo, benzeno não é um composto ácido, já o fenol (substituímos o por uma hidroxila) é ácido. Ou ainda, etano nas CNTP é um gás e etanol é um líquido, e ambos contêm dois átomos de carbono. Neste segundo caso, você consegue explicar esta diferença, não é mesmo? Basta você lembrar das ligações de hidrogênio presentes nos álcoois.
Ao olharmos uma estrutura orgânica, devemos procurar os átomos que definem suas características, os chamados grupos funcionais. Estes grupos permitem separarmos as moléculas de acordo com suas funções orgânicas. Podemos chamar os átomos diferentes de hidrogênio e carbono de heteroátomos, podendo eles serem variados, como oxigênio, nitrogênio, enxofre, entre outros. Alguns grupos funcionais são compostos sintetizados em laboratório apenas, porém, com grande aplicação em síntese, como material de partida ou reagente.
Existem diversas funções orgânicas, sendo as principais: álcoois, haletos, éteres, aminas, aldeídos, cetonas, ácidos carboxílicos e seus derivados, conforme apresentado na Figura 4.8.
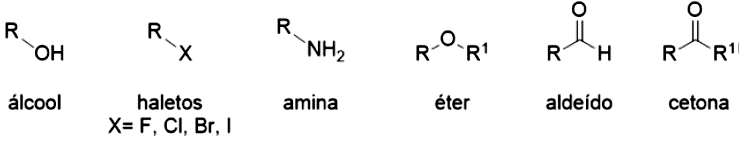
Os haletos orgânicos são moléculas orgânicas que contêm um substituinte halogênio (, , , ) (Figura 4.9). Devido à diferença de eletronegatividade entre os halogênios e o carbono, ocorre a formação de momentos de dipolo (), que caracteriza ligações polares.
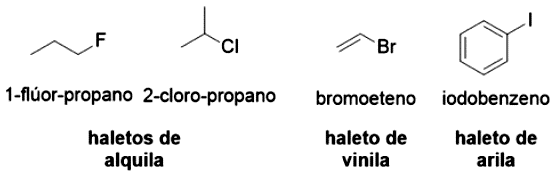
Nos alcanos, podemos classificar um carbono como primário, secundário, terciário ou quaternário, dependendo do número de átomos de carbono a que o carbono analisado está ligado. O mesmo pode ser realizado para haletos de alquila, que podem ser classificados como primários, secundários ou terciários, dependendo do átomo de carbono que o halogênio está conectado.
Quando temos um substituinte hidroxila () ligado a um átomo de carbono, a função presente é um álcool, conforme apresentado na Figura 4.10. O metanol () é o representante mais simples desta função, e o etanol () um dos representantes mais importantes comercialmente. Você também pode classificar os álcoois como primários, secundários e terciários, utilizando os mesmos critérios que os haletos de alquila.
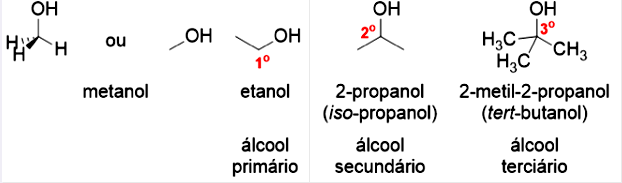
Você já deve ter notado que para nomear os álcoois você deve utilizar a nomenclatura dos hidrocarbonetos (prefixo da quantidade de carbono), e substituir o sufixo “o” por “ol”. Note que na nomenclatura dos hidrocarbonetos, “ano” é a terminação para alcano, “eno" para alceno e “ino” para alcino, nos álcoois teremos as terminações “anol”, “enol” e “inol”.
Você notou na Figura 4.10 que há uma segunda nomenclatura para o 2-propanol e para o 2-metil-2-propanol? Esta nomenclatura “iso” e “tert” é utilizada para definir cadeias ramificadas. O prefixo iso é utilizado para cadeias que possuem a substituição em uma das metilas do isopropano, o prefixo sec é utilizado quando o substituinte está no carbono secundário da cadeia, tert quando o substituinte estiver no carbono terciário e neo quando a função orgânica estiver no carbono primário.
Os álcoois são compostos com ponto de ebulição e fusão mais elevados que os alcanos, sendo que podemos comparar esta propriedade de acordo com a massa equivalente ou o número de carbonos. O etano possui um ponto de ebulição de , enquanto o etanol, também com dois carbonos, possui ponto de ebulição de . Também podemos comparar o etanol () com o propano (), já que possuem massas molares próximas. O propano possui ponto de ebulição bem menor que o etanol, de . Estas diferenças ocorrem devido à formação de ligações de hidrogênio nas moléculas de álcool. À medida que se aumenta a cadeia carbônica do álcool, o ponto de ebulição será maior. As ligações de hidrogênio presentes no álcool fazem com que álcoois metanol e etanol sejam solúveis em água, já o propanol parcialmente solúvel. Isso ocorre graças a presença de uma cadeia maior na molécula, ou seja, quanto maior o número de átomos de carbono do álcool, menos solúvel em água ele será. Quando temos mais hidroxilas em uma mesma molécula como o propano-1,2-diol () a miscibilidade em água é total, diferente do propanol.
Quando uma hidroxila está ligada a um anel benzênico você não terá um álcool, mas sim, um fenol. A hidroxila ligada ao anel aromático confere a molécula uma característica bem peculiar, ele é mais ácido que um álcool comum. Por exemplo, em uma reação ácido-base com , o fenol irá formar o sal, enquanto seu equivalente não aromático, o cicloexanol, não reagirá.
A acidez de compostos orgânicos está relacionada com a estabilidade do ânion formado, quanto mais estável ele for, mais ácido será o composto. Um dos fatores que estabiliza a carga negativa é a ressonância. No fenol, o ânion gerado tem a carga estabilizada pela ressonância do anel. No cicloexanol não há nenhum tipo de estabilização, por isso ele é menos ácido e não reage com .
De maneira geral, os álcoois podem ser considerados derivados da água, em que um dos hidrogênios foi substituído por uma cadeia carbônica. Quando ocorre a substituição do outro hidrogênio, temos uma nova função orgânica, os éteres. Os éteres podem ser classificados como simples (simétricos) ou mistos, dependendo se os substituintes possuem cadeias carbônicas idênticas ou não, conforme apresentado na Figura 4.11.
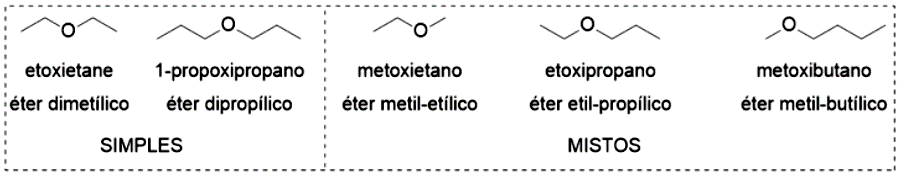
A nomenclatura de éteres pode ser dada pelo nome sistemático (IUPAC), em que a regra envolve o nome do substituinte menor (metil, etil propil, butil etc.) menos o sufixo “il” mais o sufixo “oxi”, adicionando ao nome do hidrocarboneto maior. Uma segunda nomenclatura pode ser utilizada com o emprego da palavra éter, mais substituinte menor (metil, etil etc.), mais substituinte maior terminado em -ílico. Exemplos das duas nomenclaturas estão na Figura 11 e um esquema explicativo da nomenclatura de éteres está na Figura 4.12.
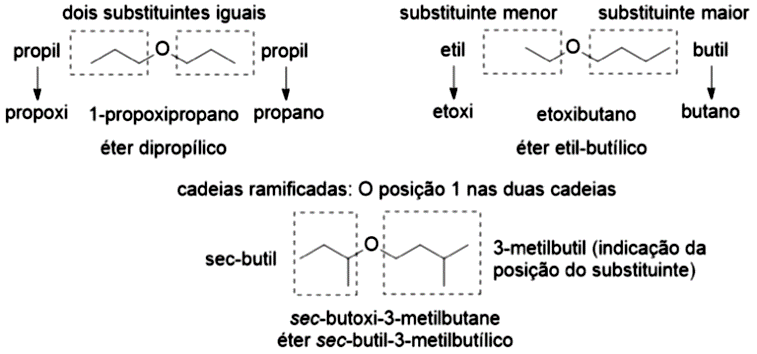
Os éteres são moléculas com baixa polaridade, que não realizam ligações de hidrogênio como os álcoois. Você pode imaginar que isso resulta em propriedades bem distintas com relação aos seus isômeros. O éter dimetílico apresenta ponto de ebulição de . O éter dietílico apresenta ponto de ebulição de e é um importante solvente, mesmo sendo levemente inflamável. O éter dietílico é pouco solúvel em água ( de água), sendo que na proporção de até quatro átomos de carbono por átomo de oxigênio alguma solubilidade é observada, acima disso, éteres são insolúveis.
Assim como álcoois e éteres podem ser interpretados como derivados orgânicos da água, já a função amina pode ser considerada como derivado orgânico da amônia (). A amônia é muito semelhante à água, ambas realizam ligações de hidrogênio e são polares. As aminas possuem como grupo funcional o nitrogênio, podendo ser aminas primárias (), secundárias () ou terciárias (. ), de acordo com o número de cadeias carbônicas ligadas ao átomo de nitrogênio (Figura 4.13).
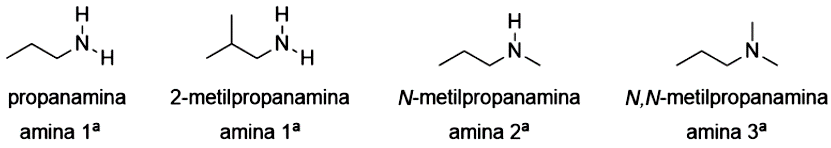
Com relação à nomenclatura, você deve ter notado na Figura 4.13, que se utiliza o nome do substituinte (propil, metil etc.) acrescido do tipo de cadeia (an, em e in) e a palavra amina. Também é comum utilizar apenas propilamina no lugar de propanamina. Algumas aminas são trivialmente nomeadas com o nome de suas fontes como a putrescina () e a cadaverina (), encontradas na carne em decomposição.
Siga em Frente...
Aminas pequenas são solúveis em água, porém a maior parte não apresenta elevadas solubilidades. As aminas são bases e, em presença de ácidos, formam sais. Se você desenhar a estrutura de Lewis desta molécula, irá notar que as aminas possuem um par de elétrons não ligantes, este par de elétrons confere a basicidade às aminas.
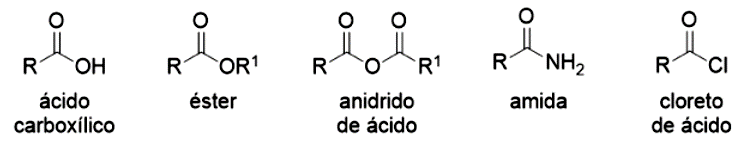
O grupo carboxílico define os ácidos carboxílicos ( ou ), sendo o mais simples o ácido fórmico, que tem este nome por ser produzido por formigas. Você já deve ter sido picado por uma e pôde evidenciar que ele é um líquido irritante, sendo um dos responsáveis pela ardência da picada (SOLOMONS et al, 2013). O ácido acético também é seu conhecido, já que ele é responsável pelo gosto ácido do vinagre, sendo proveniente da oxidação do etanol do vinho. O ácido 2-hidroxi-1,2,3-propanotricarboxílico também faz parte do seu dia a dia, mas com este nome fica difícil de reconhecê-lo, não é mesmo? Ele é o ácido cítrico, presente em diversas frutas, como o limão. A Figura 4.14 apresenta alguns ácidos carboxílicos e onde eles são encontrados (KOTZ et al, 2014; SOLOMONS et al 2013).
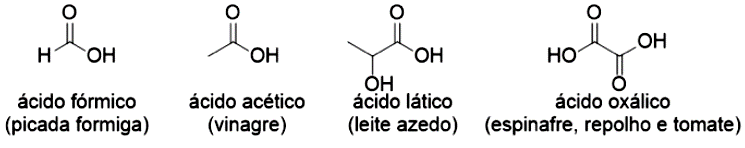
Os ácidos normalmente são nomeados dependendo de onde foram obtidos, como os já mostrados anteriormente, mas existem os nomes sistemáticos dados retirando o sufixo “o” do hidrocarboneto correspondente e a adição do sufixo “oico”, adicionando a palavra ácido antes do nome. Com relação aos seus aspectos, note que desde o ácido mais simples (ácido fórmico) eles já se apresentam na forma de líquidos, o que podemos explicar pelas ligações de hidrogênio possíveis nesta função. Os ácidos com estruturas de maior massa podem existir como sólidos à temperatura ambiente.
Como a maioria dos ácidos orgânicos, o ácido acético é um ácido fraco e solúvel em água. Sua acidez é explicada pela perda do hidrogênio do grupo carboxílico, os ácidos carboxílicos em água produzem o íon hidrônio e um carboxilato, com formam água e carboxilato de sódio, reagindo totalmente. A solubilidade você pode explicar devido à polaridade da molécula, os dois átomos de oxigênio da carboxila apresentam maior eletronegatividade que o carbono, apresentando assim , o hidrogênio, por sua vez, apresenta uma , estas duas características possibilitam a formação de ligações de hidrogênio com a água. Note, com isso, que ácidos carboxílicos de cadeia carbônica longa devem ser menos solúveis.
Algumas funções orgânicas podem ser obtidas a partir de ácidos carboxílico, sendo conhecidas como derivadas de ácidos carboxílicos e são amplamente encontradas na química orgânica. Essas funções desempenham papéis importantes em diversos processos biológicos e industriais, elas incluem os ésteres, amidas, anidridos, haletos de ácido e outros compostos que resultam da substituição de um ou mais hidrogênios do grupo carboxila por diferentes grupos funcionais. Cada uma dessas classes de compostos apresenta propriedades e aplicações distintas, como a presença de ésteres em óleos e gorduras, amidas em proteínas e haletos de ácido em reações de síntese orgânica. Essas funções derivadas fornecem uma rica variedade de substâncias com propriedades únicas e versatilidade química, sendo essenciais em muitos campos da química e da biologia.
Mas estudante, como é possível identificar uma função orgânica? Os diferentes grupos funcionais podem ser observados por diversas técnicas. Uma delas é a análise de infravermelho (). Esta técnica consiste em irradiar as moléculas da amostra, fazendo com que os átomos vibrem em torno das ligações covalentes que os ligam. Como os grupos funcionais apresentam átomos organizados de maneira diferente, cada grupo vibra de uma maneira própria. Por conta disso, eles absorvem energia no em regiões específicas, resultando em um espectro de absorção. Álcoois que realizam ligações de hidrogênio apresentam um sinal largo característico na região de no espectro de , já aminas apresentam um sinal fino na mesma região (SOLOMONS; FRYHLE; JOHNSON, 2013)..
Vamos Exercitar?
Estudante, nesta aula você trabalhou com as funções orgânicas. Função orgânica refere-se a grupos de átomos com características específicas que conferem propriedades e reatividade distintas a compostos orgânicos, ela determina o comportamento químico e as aplicações dos compostos em diversos processos industriais, biológicos e ambientais. Nesse contexto, você conheceu e compreendeu as características de função oxigenadas, que são aquelas que possuem um heteroátomo de oxigênio em sua estrutura, e as funções nitrogenadas, que são aquelas que apresentam um átomo de nitrogênio em sua cadeia.
Para aplicar esses temas, vamos retornar a nossa situação proposta, que consiste na obtenção de moléculas a serem empregadas na indústria alimentícia. Desse modo, para resolver este problema, você precisa procurar um método que permita monitorar constantemente se o produto está sendo obtido, para registrar quando isso ocorre. Você tem nos reagentes um éter (adoçante) e como produto de decomposição um álcool, duas funções com características bastante distintas, isso porque, embora nas duas moléculas o oxigênio esteja ligado ao carbono, apenas em um deles temos a ligação , sendo possível realizar ligação de hidrogênio. Esta é uma excelente oportunidade para o uso de uma análise de infravermelho. Os álcoois apresentam um sinal no espectro de infravermelho (em ), então, você pode realizar análises de infravermelho de tempos em tempos até que este sinal surja. Neste ponto, você está observando a decomposição do éter.
O custo desta análise é praticamente o equipamento de IV, existem ainda equipamentos de infravermelho que podem ser utilizadas como sensor interno (dentro da reação) com monitoramento constante. Outras informações podem ser necessárias para compreender melhor a situação proposta. Continue estudando!
Saiba Mais
Para saber mais sobre as funções orgâcnias, acesse a biblioteca virtual e faça a leitura do capítulo 14 “Álcoois, éteres e tióis”, do capítulo 16 “Aminas” e capítulo 18 “Ácidos carboxílicos” do livro “Introdução à química geral, orgânica e bioquímica”, disponível na Minha Biblioteca.
BETTELHEIM, Frederick A.; BROWN, William H.; CAMPBELL, Mary K.; FARRELL, Shawn O. Introdução à química geral, orgânica e bioquímica - Combo: Tradução da 9ª edição norte-americana. São Paulo: Cengage Learning Brasil, 2016. Disponível em: <https://integrada.minhabiblioteca.com.br/#/books/9788522126361/>. Acesso em: 09 mar. 2024.
Para compreender e aprofundar seus conhecimentos sobre funções oxigenadas, faça a leitura do artigo: “Sabonete de erva cidreira (Lippia alba): uma proposta para o ensino de
funções oxigenadas”, disponível em: https://www.researchgate.net/profile/Erasmo-Junior/publication/371605060_Sabonete_de_erva_cidreira_Lippia_alba_uma_proposta_para_o_ensino_de_funcoes_oxigenadas/links/648bc80bb9ed6874a5b196f0/Sabonete-de-erva-cidreira-Lippia-alba-uma-proposta-para-o-ensino-de-funcoes-oxigenadas.pdf. Acesso em: 09 mar. 2024.
Por fim, aprofunde seus conhecimentos sobre as funções nitrogenadas por meio da leitura do texto “Funções nitrogenadas na abordagem sobre “drogas”: Ensino de química e aprendizagem significativa (AS)”, disponível em: https://repositorio.ifes.edu.br/bitstream/handle/123456789/1129/Disserta%c3%a7%c3%a3o Jussan%c3%a3 Luzia Venturin Caus 16092020.pdf?sequence=3&isAllowed=y. Acesso em: 09 mar. 2024.
Referências Bibliográficas
ATKINS, Peter; JONES, Loretta; LAVERMAN, Leroy. Princípios de química: questionando a vida moderna e o meio ambiente. Porto Alegre: Grupo A, 2018.
CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Rio de Janeiro: Mcgraw Hill, 2013.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017.
SOLOMONS, T. W. G.; FRYHLE, C. B.; JOHNSON, R. G. Química orgânica. Rio de Janeiro: LTC, 2012.
Encerramento da Unidade
Princípios de Química Inorgânica e Orgânica
Videoaula de Encerramento
Olá, estudante! Nesta videoaula você irá trabalhar com os conceitos pertinentes as funções inorgânicas e orgânicas. Esse conteúdo é importante para a sua prática profissional, pois as funções inorgânicas são essenciais em diversos setores industriais, desde a produção de alimentos até a fabricação de produtos químicos. Já as funções orgânicas são fundamentais na síntese de medicamentos, plásticos e combustíveis, impactando diretamente na prática profissional de químicos, engenheiros e profissionais de diversas áreas. Bons estudos! Vamos lá!
Ponto de Chegada
Olá, estudante! Para desenvolver a competência desta Unidade, que é conhecer e compreender as características das funções inorgânicas e orgânicas, você precisa compreender inicialmente o significado de função química, que é um conjunto de substâncias que possuem características químicas semelhantes devido à presença de um grupo funcional específico. Esses grupos determinam o comportamento e as propriedades das substâncias, como ácidos, bases, hidrocarbonetos, entre outros. Além disso, eles desempenham papéis distintos em processos químicos e têm diversas aplicações na indústria, na medicina e em outras áreas.
Quanto ao estudo das funções inorgânicas, temos as definições de Arrhenius e Bronsted-Lowry para ácidos e bases, abrangendo uma gama grande de substâncias que apresentam esse tipo de comportamento. Arrhenius define ácido como uma espécie que libera íons H+ em solução aquosa e a base como uma espécie que libera OH-. Já Bronsted-Lowry define compostos ácidos como doadores de H+ e as bases como receptores de H+. Essas definições são importantes na química pois permitem uma interpretação mais abrangente e precisa das propriedades ácido-base, levando a uma melhor compreensão das interações químicas e possibilitando o desenvolvimento de aplicações práticas em diversas áreas, como na indústria, na agricultura e na medicina. Além disso, você vai compreender as características e as propriedades que estes compostos apresentam, como sua classificação quanto a sua estrutura química, sua força e as regras de nomenclatura empregadas.
Em relação as funções inorgânicas dos sais, você vai conhecer as características que estes compostos apresentam, suas propriedades e as regras de nomenclatura. Quanto aos óxidos, será vista a definição de óxidos, sua classificação em diferentes categoriais, como os óxidos ácidos, os óxidos básicos, os anfóteros e os mistos, seguido pelas regras de nomenclatura. Ao final das funções inorgânicas, você vai conhecer a função dos hidretos, que são compostos importantes que possuem o hidrogênio como ânion da substância e, consequentemente, apresentam aplicações específicas devido as suas propriedades e características.
Já no inicio do estudo das funções orgânicas, você será apresentado as teorias fundamentais da química orgânica, assim como verá a estrutura do átomo de carbono por meio dos processos de hibridização, finalizando com as propriedades, características e classificação do átomo de carbono e das cadeias carbônicas. A partir desse ponto, você vai conhecer as funções orgânicas, iniciando pelos hidrocarbonetos, que são compostos formados por átomos de carbono e hidrogênio. Essa função é dividida em alcanos, alcenos, alcinos e compostos aromáticos.
Por fim, você terá a introdução as funções oxigenadas, que são aquelas que apresentam um heteroátomo de oxigênio em sua estrutura e as funções nitrogenadas, que apresentam o átomo de nitrogênio, finalizando o estudo com uma breve introdução aos ácidos carboxílicos e seus derivados.
Todas essas informações são fundamentais para que você possa atingir a competência proposta e apresente os resultados de aprendizagem esperados. Então, vamos embarcar nessa fascinante jornada do conhecimento! Bons estudos!
É Hora de Praticar!
Estudante, as moléculas constituídas por carbono estão no centro do desenvolvimento de nossa sociedade. Nas roupas que usamos, em produtos aplicados na agricultura, ou na indústria alimentícia, ou ainda na indústria farmacêutica. Devido à sua importância, devemos conhecer as principais características das moléculas orgânicas. O que define estas propriedades? Esta resposta é simples: as funções orgânicas.
Desse modo, você se colocará na posição de um estagiário em um laboratório de pesquisa e desenvolvimento em uma indústria de obtenção de pesticidas. Em sua função, você deve ser capaz de escolher solventes adequados para um processo químico e utilizar as propriedades das moléculas orgânicas para recuperar compostos de grande valor agregado e, ainda. Como reconhecer estruturas de moléculas orgânicas? Como relacionar suas estruturas com suas propriedades?
Pensando no exposto, você deverá solucionar os questionamentos levantados a seguir:
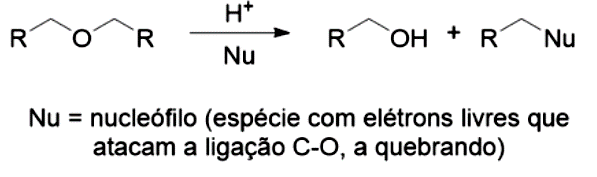
- Você está atuando no setor de pesquisa e desenvolvimento, seu gestor solicitou que você fizesse um levantamento de quais compostos poderiam ser utilizados como solventes em uma reação envolvendo moléculas apolares. Moléculas apolares apresentam apenas interações intermoleculares do tipo London. Com isso, você logo pensou em moléculas também apolares. Entre as funções orgânicas, você irá notar que além dos átomos que compõem a molécula, a organização deles influência nesta característica de polaridade. Com esta ideia na cabeça, você foi ao almoxarifado da empresa e solicitou ao responsável as moléculas apolares que havia em grande quantidade. Ele te passou nove moléculas compostas apenas por carbonos. Por que apenas estas? Todas podem ser utilizadas? Quais os critérios que você deve utilizar em sua escolha?
- Agora você precisa verificar, em uma etapa reacional da rota sintética estudada, que alguns produtos de grande valor agregado estavam sendo perdidos, eles sobravam no meio reacional. Isto estava acarretando um gasto excessivo na compra de reagentes. Uma alternativa era conseguir purificar estes compostos e reutilizá-los. Como você progrediu muito bem na primeira etapa do projeto, seu gestor solicitou que você separasse e purificasse estes compostos de uma mistura obtida após uma reação. Esta mistura era composta por fenol substituído, uma amina e um álcool, que são subprodutos obtidos após purificação de uma reação de obtenção de um éter. Sua limitação está na estabilidade dos compostos envolvidos, que não podem ser aquecidos por sofrerem decomposição. Qual a diferença entre um fenol e um álcool comum? Quais as características das aminas? No que estes compostos diferem? Bons estudos!
Reflita
Como a compreensão dos princípios ácido-base, como definidos pelas teorias de Arrhenius e Bronsted-Lowry, é fundamental para o desenvolvimento e produção de medicamentos na indústria farmacêutica?
Como a compreensão das propriedades e reatividade dos hidrocarbonetos é crucial na indústria petrolífera para a exploração, produção e refinamento de petróleo e seus derivados?
Como as funções oxigenadas, incluindo álcoois, éteres, aldeídos e cetonas, desempenham um papel crucial no desenvolvimento de moléculas ativas e no desenvolvimento de fármacos na indústria farmacêutica?
Resolução do estudo de caso
Estudante, como estagiário no setor de pesquisa e desenvolvimento de uma indústria de pesticidas, seu gestor solicitou que você indicasse quais compostos a empresa possuía em estoque e que pudessem ser utilizados como solventes em uma reação de obtenção de um composto intermediário na obtenção de novo pesticida. Como as moléculas envolvidas na reação eram apolares, você logo pensou em utilizar como solvente uma molécula também apolar. Como selecionar moléculas apolares que possam ser utilizadas como solvente? Toda molécula apolar pode ser utilizada? Quais critérios você deve seguir nesta escolha?
Os hidrocarbonetos são moléculas apolares, então, por que não os utilizar como solventes? Um critério a ser levado em consideração é a estabilidade das moléculas, pois o solvente não deve reagir nas condições de reação empregadas no reator. Como você não tem muitos detalhes sobre o processo empregado, o ideal é que selecione moléculas estáveis. Alcenos e alcinos possuem ligações e isso os torna reativos, então, não são uma boa escolha.
Com isso, vamos focar nossa decisão entre alcanos, cicloalcanos e compostos aromáticos. O propósito em se utilizar solvente em uma reação é facilitar que as moléculas entrem em contato sem que a reação ocorra de maneira violenta, portanto, é ideal escolhermos compostos líquidos na temperatura ambiente. Também é preciso investigar a temperatura da reação, pois imagina se você escolhe um composto com ponto de ebulição abaixo da temperatura de reação? Ou ainda um composto com ponto de fulgor baixo e a reação pega fogo, causando um acidente na planta industrial? Ponto de fulgor ou de inflamação é a menor temperatura em que o composto libera vapor em quantia suficiente para inflamar. Você questionou seu gestor e foi informado que a reação ocorre na temperatura ambiente, isso facilita muito sua busca.
Em uma pesquisa no estoque, você listou nove hidrocarbonetos em quantidade suficiente para serem empregados como solvente, apresentados na Figura 4.16.
Analisando as estruturas, como já mencionado, alcenos e alcinos não servem, eliminando assim as estruturas B, E e G. A estrutura A é um alcano de baixo peso molecular, portanto, também deve ser eliminado, já que é um gás (). Pelo estado físico à temperatura ambiente, o composto I também é eliminado, pois é sólido (). Devido a seus pontos de ebulição serem elevados, o tolueno (F, ) e o xileno (H, ) são compostos que podem ser selecionados, lembre-se que por serem aromáticos, eles são bastante estáveis. Os compostos hexano (C) e cicloexano (D) são boas escolhas como solventes, seus pontos de ebulição são e . O cicloexano apresenta maior ponto de fulgor () que o hexano (), porém são valores muito próximos. Você deve agora pesquisar um pouco sobre a toxicidade destes compostos na literatura, assim você terá uma resposta bem mais completa.
Dando sequência, agora vamos pensar no segundo questionamento. Na sua função de estagiário, você recebeu a tarefa de recuperar subprodutos de uma reação. Estes compostos são importantes devido ao alto valor de compra. Sua tarefa é após a purificação da reação, recuperar os reagentes de alto custo. Na obtenção de um éter de grande interesse (Figura 4.17), após purificação do produto principal, foi obtida uma mistura de álcool subproduto , o fenol de partida e a base utilizada na reação. Seu gestor solicitou que você recuperasse o fenol e o álcool obtidos como subprodutos, para que eles fossem reutilizados. Entretanto, deixou claro que estes compostos são sensíveis ao calor, não podendo ser aquecidos para remoção em rotaevaporador. Qual abordagem você pode utilizar para separar estes compostos?
Após pensar em uma estratégia, você decidiu utilizar as características de acidez e basicidade das diferentes funções. A trietilamina é uma amina, portanto, é básica e por isso você consegue realizar uma reação com ácido para que ela seja protonada () e forme um sal. Você pode utilizar para formar o sal , que é insolúvel em diversos solventes, como o éter dietílico. Assim, você consegue realizar uma filtração e remover o excesso de trietilamina na forma de um sal. Para remover o fenol substituído, você pode utilizar a maior acidez dos álcoois comuns, formando um sal por adição de , realizando uma nova filtração. Estas etapas estão esquematizadas na Figura 4.18, sendo que após estas duas remoções você tem no meio o álcool e o produto desejado.
Para obter o fenol novamente, você precisa acidificar o meio. E, com isso, conclui sua tarefa de recuperação dos compostos de alto custo e finaliza as demandas recebidas em sua atuação como estágio em uma empresa produtora de pesticidas.
Dê o play!
Assimile
Estudante, está preparado para se aventurar em um universo cativante de substâncias e suas propriedades? Convido-o a iniciar uma jornada de exploração sobre as diversas funções químicas que moldam o nosso mundo. Vamos começar falando sobre os ácidos e bases, conforme definidos pelas teorias de Arrhenius e Bronsted-Lowry. Entenderemos como essas substâncias se comportam em soluções aquosas, influenciando uma variedade de processos químicos e biológicos.
Em seguida, mergulharemos no mundo dos sais, óxidos e hidretos, explorando suas estruturas e propriedades únicas. Descobriremos como essas substâncias desempenham papéis essenciais em diversos campos, desde a indústria até a agricultura. Não podemos esquecer dos hidrocarbonetos, que compõem a base de muitos compostos orgânicos. Investigaremos os alcanos, alcenos, alcinos e compostos aromáticos, explorando suas estruturas e reatividades distintas.
Por fim, exploraremos as funções orgânicas, incluindo as funções oxigenadas e nitrogenadas. Conheceremos os compostos que contêm oxigênio, como álcoois e éteres e aqueles que contêm nitrogênio, como as aminas. Compreenderemos como essas funções orgânicas estão presentes em uma variedade de produtos químicos, medicamentos e materiais do nosso cotidiano. Prepare-se para desvendar os segredos da química e suas aplicações no mundo ao nosso redor. Boa exploração!
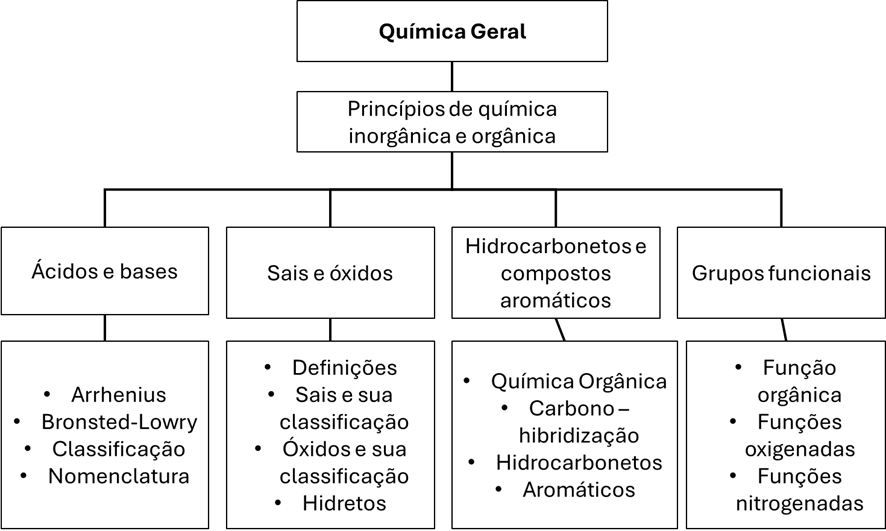
Referências
ATKINS, P.; Jones, L. Princípios de química - questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
CHANG, Raymond; GOLDSBY, Kenneth A. Química. 11. ed. Rio de Janeiro: Mcgraw Hill, 2013.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
KOTZ, John C. et al. Química geral e reações químicas. 9. ed. São Paulo: Cengage Learning, 2010, v. 1-2.
SOLOMONS, T. W. G.; FRYHLE, C. B.; JOHNSON, R. G. Química orgânica. Rio de Janeiro: LTC, 2012.