Anatomofisiologia e Patologia do Sistema Urinário
Aula 1
Visão Geral do Sistema Urinário
Visão geral do sistema urinário
Olá, estudante! Nesta videoaula, você irá conhecer o sistema urinário. Você irá explorar as principais características anatômicas, histológicas e funcionais desse sistema. Você será capaz de compreender a estrutura macroscópica e microscópica das estruturas desse sistema tão fundamentais para a manutenção da homeostase corporal. Prepare-se para essa jornada fantástica pelo sistema renal! Vamos lá!
Ponto de Partida
Nesta aula, você, estudante, irá conhecer o sistema urinário, que atua principalmente por meio dos rins promovendo a homeostasia dos líquidos corporais, assim como participa de outras funções importantes que auxiliam na manutenção da homeostase corporal. Você será capaz de conhecer as diferentes estruturas que fazem parte do sistema urinário, suas características morfológicas, anatômicas e funcionais, que implicam diretamente na manutenção da homeostasia corporal. Assim, você será capaz de reconhecer como todas essas características possibilitam a compreensão e aplicação desses conhecimentos no seu dia a dia profissional. Prepare-se para essa nova jornada de conhecimento! Vamos lá!
A partir de agora, você irá acompanhar a rotina de Daniel, um aluno de graduação na área da saúde, que realiza seu estágio junto à equipe do Programa de Atenção Integral à Saúde de sua Universidade. Nesse momento, Daniel está acompanhando as discussões de casos clínicos de alguns atendimentos realizados por uma Unidade Básica de Saúde (UBS) parceira do Programa. Durante a discussão, foi abordado o caso clínico da paciente T.M.S, 24 anos, que compareceu à consulta queixando-se de dor e ardência ao urinar há três dias, além de vontade de urinar com maior frequência nas últimas 24 horas. Segundo a paciente, a urina estava com coloração mais escura, mas sem alteração de cheiro. A paciente não apresentava febre e negou a presença de outras comorbidades. Como no exame clínico não foram observadas anormalidades, foi solicitado exame de urina. O resultado do exame mostrou bacteriúria, piúria e hematúria. Diante do quadro clínico apresentado e dos resultados do exame, foi diagnosticada com cistite. A paciente foi medicada com antibiótico e, ao fim do tratamento, compareceu em consulta de retorno, apresentando-se assintomática, recebendo alta ambulatorial. Ainda durante a discussão desse caso clínico, o supervisor do Programa aproveitou para instigar Daniel a relembrar alguns conceitos importantes a respeito das características anatômicas e funcionais do sistema urinário. Ele fez os seguintes questionamentos a Daniel: “o que é a cistite? Você saberia explicar quais estruturas são acometidas na cistite? Qual é a importância dessas estruturas para o funcionamento do nosso organismo?”
Como você, no lugar de Daniel, responderia a todos esses questionamentos?
Vamos Começar!
O sistema urinário é formado pelos rins, ureteres, bexiga urinária e uretra. A principal função desse sistema é a excreção de substâncias do corpo. Essa função tão importante é realizada pelos rins, enquanto as demais estruturas desse sistema atuam como vias de passagem e locais de armazenamento.
Dentre as funções dos rins, podemos destacar:
- Regulação da composição iônica do sangue: ajudam a regular a concentração de íons como Na+, Cl-, K+, Ca+2, HCO3-, HPO4-2, entre outros.
- Regulação do pH sanguíneo: por meio do controle da quantidade de H+ excretados na urina e pela preservação de HCO3-, essenciais para atuação do tampão H+ no sangue e, consequentemente, para a manutenção do pH sanguíneo.
- Regulação do volume sanguíneo: realizando ajustes no volume sanguíneo por meio de alterações no volume de água eliminada por meio da urina.
- Regulação da pressão arterial: realizado pelos ajustes no volume de água eliminado e pela secreção de renina, uma enzima que ativa o sistema renina-angiotensina-aldosterona;
- Gliconeogênese: no jejum prolongado, os rins podem sintetizar glicose a partir de aminoácidos e outros precursores, liberando-a no sangue e, dessa forma, auxiliando na manutenção da glicemia.
- Produção dos hormônios eritropoetina e calcitriol: a eritropoetina controla a síntese de hemácias na medula óssea vermelha, enquanto o calcitriol (1,25-di-hidroxivitamina D) atua na regulação da homeostasia do cálcio no organismo.
- Excreção: os rins são responsáveis pela excreção de produtos da degradação metabólica como a ureia (proveniente do catabolismo das proteínas), o ácido úrico (oriundo do catabolismo de ácidos nucleicos), a creatinina (formada pela quebra do fosfato de creatina nas fibras musculares), entre outras substâncias. Substâncias estranhas como fármacos, toxinas, pesticidas e aditivos alimentares também são eliminados pelos rins por meio da urina.
Siga em Frente...
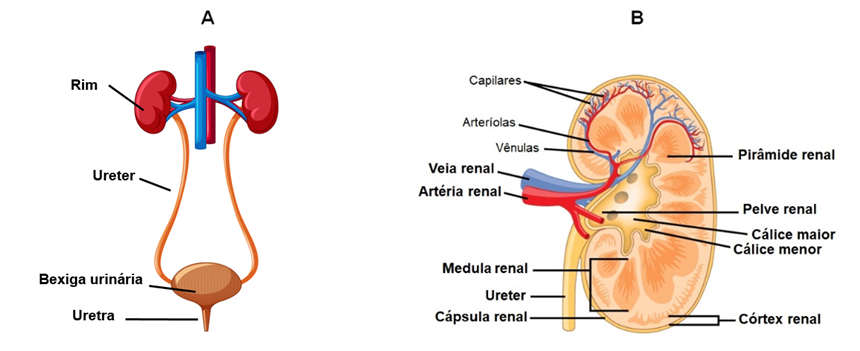
Rim
Os rins são órgãos em forma de feijão, com tamanho aproximado de um punho fechado. Estão localizados na parte posterior da parede abdominal, atrás do peritônio parietal, sendo por esse motivo denominados estruturas retroperitoneais. Cada rim é circundado por uma camada de tecido conjuntivo fibroso denominada cápsula renal. Envolvendo a cápsula renal encontramos a cápsula adiposa renal, formada de tecido adiposo, que protege os rins de traumatismos, amortecendo choques mecânicos. Ainda, envolvendo a cápsula adiposa renal está a fáscia renal, uma camada fina de tecido conjuntivo que auxilia na fixação dos rins ao peritônio e parede abdominal. No lado medial, côncavo, do rim encontramos o hilo renal, local de entrada para artéria renal e os nervos e de saída para a veia renal e ureter.
Cada rim é formado por duas regiões distintas: córtex renal, mais externo e em contato com a cápsula renal, e medula renal, mais localizada mais internamente. A medula renal é constituída por estruturas em forma de cone chamadas pirâmides renais, entre as quais porções do córtex renal se estendem formando as colunas renais. Os ápices das pirâmides renais são denominados papilas renais e encontram-se direcionadas para a região interna do rim. Cada papila renal se projeta para uma depressão pequena chamada cálice menor. Os cálices menores de diferentes pirâmides se unem formando cálices maiores e, estes, por sua vez, se unem formando uma câmara alargada chamada pelve renal. A função da pelve renal é coletar a urina dos cálices e transportar para o ureter.
O córtex renal, juntamente com as pirâmides renais, forma o parênquima, a porção funcional do rim. Dentro do parênquima, encontramos as unidades funcionais dos rins, responsáveis pela formação da urina, denominadas néfrons. Cada néfron é formado por um corpúsculo renal e um túbulo renal. O corpúsculo renal é composto pelo glomérulo e cápsula de Bowman, enquanto o túbulo renal apresenta três partes principais, túbulo contorcido proximal, alça de Henle e túbulo contorcido distal. Os túbulos contorcidos distais de vários néfrons drenam para um único ducto coletor. Assim, os néfrons são estruturas microscópicas, sendo encontradas mais de um milhão delas em cada rim, envoltas por pequenos vasos sanguíneos. O líquido filtrado a partir do capilar sanguíneo e que entra no néfron é chamado de filtrado. Este é modificado à medida que percorre as estruturas do néfron, por meio de diferentes processos de transporte. Assim, o filtrado formado no néfron drena para os ductos coletores e, destes, para os cálices renais menores e maiores. A partir do momento que o filtrado chega nos cálices, passa a ser chamado de urina, uma vez que a partir dessa estrutura não ocorre mais alterações nesse líquido, por processos como reabsorção e secreção. Dos cálices, a urina drena para a pelve renal e, daí, para o ureter e, posteriormente, para a bexiga urinária.
O rim é uma estrutura extremamente vascularizada, o que torna suas funções bastante efetivas. O sangue arterial entra no rim por meio da artéria renal, localizada no hilo, que se ramifica em artérias segmentares que, por sua vez, se divide em artérias interlobares. Estas passam entre as pirâmides renais através das colunas renais em direção ao córtex e se ramificam em artérias arqueadas. Cada artéria arqueada origina várias artérias interlobulares, que se projetam no interior do córtex renal. Cada artéria interlobular origina várias arteríolas glomerulares aferentes, que suprem individualmente os néfrons, mais especificamente os glomérulos. O sangue que não é filtrado no glomérulo deixa essa estrutura a partir das arteríolas glomerulares eferentes, seguindo para os capilares intertubulares (que envolvem os túbulos contorcidos dos néfrons) ou para as arteríolas retas (envolvem os túbulos ascendentes e descendentes dos néfrons). A partir desses capilares, o sangue é drenado do rim para as veias interlobulares, veias arqueadas e veias interlobares. Estas últimas passam pelas pirâmides renais e formam a veia renal, que deixa o rim através do hilo e desemboca na veia cava inferior.
Processos básicos dos néfrons
Nos néfrons ocorrem três processos básicos cujo resultado é a produção da urina. Os processos são:
- Filtração: é caracterizada pela passagem de líquido e grande parte dos solutos do sangue para o néfron. Esse processo ocorre no corpúsculo renal, onde a água e solutos atravessam inicialmente as paredes dos capilares glomerulares e, depois, a cápsula de Bowman, dirigindo-se para os túbulos renais. O fluido que atravessa essas estruturas passa a ser chamado de filtrado.
- Reabsorção: à medida que o filtrado flui através dos túbulos renais e ductos coletores, a água e os solutos úteis são reabsorvidos do lúmen tubular de volta para o sangue, através dos capilares peritubulares.
- Secreção: à medida que o filtrado flui através dos túbulos renais e ductos coletores, substâncias são seletivamente secretadas para o lúmen tubular. Dessa forma, substâncias como resíduos metabólicos, excesso de íons e fármacos são removidos do sangue para o lúmen tubular, sendo excretados pela urina.
Ureteres
Os ureteres constituem um par de tubos que se iniciam como uma continuação da pelve renal, seguindo inferiormente até a bexiga urinária. Os ureteres penetram através da parede posterior da bexiga urinária formando o óstio do ureter. A função dos ureteres é transportar a urina dos rins para a bexiga urinária. A parede do ureter é formada por três camadas ou túnicas: 1) camada mucosa: é a camada mais profunda, consistindo em um epitélio de transição e uma lâmina própria. Células caliciformes presentes nessa camada secretam muco que recobre a parede do ureter, impedindo que as células entrem em contato com a urina; 2) camada muscular: camada intermediária constituída por uma camada longitudinal interna e uma camada circular externa de músculo liso. No terço distal dos ureteres, há também uma camada externa à camada circular composta de fibras musculares longitudinais. A principal função da camada muscular é o peristaltismo, permitindo o movimento da urina através dos ureteres em direção à bexiga urinária; e, 3) camada adventícia: camada mais externa do ureter, sendo constituída de tecido conjuntivo. Mantém os ureteres em posição.
Bexiga
Outra estrutura que faz parte do sistema urinário é a bexiga urinária, um órgão muscular oco, distensível, localizado na cavidade pélvica posterior à sínfise púbica. A função da bexiga urinária é armazenamento temporário da urina. Nas mulheres, a bexiga urinária encontra-se posterior à vagina e inferior ao útero, enquanto, nos homens, está anterior ao reto. O formato da bexiga pode variar de acordo com o volume de urina armazenado no seu interior. Seu formato é esférico, tornando-se achatada quando vazia; porém, conforme vai enchendo de urina, a bexiga urinária torna-se piriforme, ascendendo para a cavidade abdominal. No assoalho da bexiga urinaria, encontramos uma área triangular chamada trígono da bexiga. Essa área é delimitada pelos óstios dos ureteres e pelo óstio interno da uretra e atua como um funil, direcionando a urina para a uretra quando a bexiga urinária se contrai. A parede da bexiga urinária é formada por três camadas, sendo a mais profunda, a túnica mucosa, constituída por epitélio de transição e lâmina própria, bem semelhante ao observado nos ureteres. A presença desse epitélio de transição permite o estiramento da parede da bexiga, assim como a presença das pregas de mucosa. A camada intermediária, chamada túnica muscular ou músculo detrusor da bexiga, composta por três camadas de músculo liso: duas longitudinais (interna e externa) e uma circular que se encontra disposta entre elas. A contração do músculo detrusor da bexiga é responsável por expelir a urina para o interior da uretra. Ao redor da abertura da uretra, as fibras musculares circulares formam o esfíncter interno da uretra, responsável pelo controle involuntário da bexiga sobre a eliminação da urina. A camada mais externa da bexiga urinária é a adventícia, presente somente na face posterior e inferior da bexiga, formada por tecido conjuntivo. Revestindo externamente a porção superior da bexiga, encontramos a túnica serosa, formada por uma camada de peritônio.
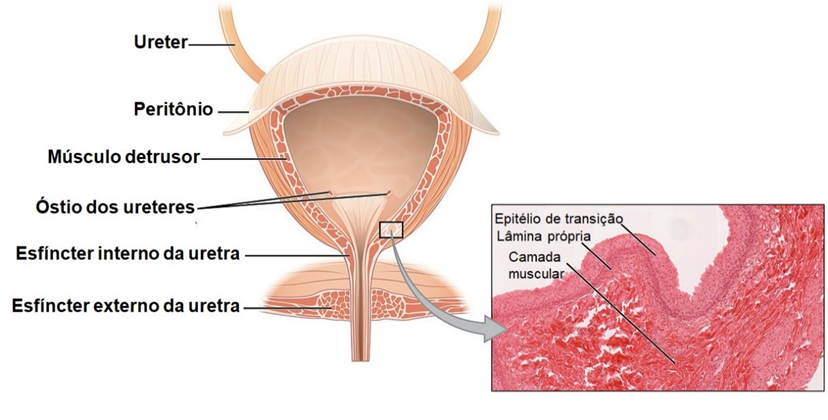
Uretra
Ainda, no sistema urinário, encontramos a uretra, um órgão tubular pequeno que se estende do óstio interno da uretra, no assoalho da bexiga, até o óstio externo da uretra no limite com a região externa do corpo. Sua função é conduzir a urina da bexiga urinária até o meio externo. Existem algumas diferenças anatômicas e funcionais entre a uretra masculina e feminina. Nas mulheres, a uretra é mais curta (cerca de 4 cm de comprimento), se estendendo da bexiga até o óstio externo da uretra, localizado no vestíbulo da vagina, entre o clitóris e a abertura vaginal. Sua parede é constituída de uma camada mucosa profunda e uma camada muscular superficial. A camada mucosa é formada por epitélio e uma lâmina própria. Nas proximidades do assoalho da bexiga, encontramos epitélio de transição e nas proximidades do óstio externo da uretra, epitélio estratificado pavimentoso não queratinizado. Entre essas duas regiões a camada mucosa é formada por epitélio estratificado colunar ou pseudoestratificado colunar. A camada muscular é formada por fibras musculares dispostas de forma circular e em continuidade com a bexiga urinária. Nas mulheres, a uretra apresenta somente função de transporte da urina da bexiga para o meio externo. Nos homens, a uretra é mais longa (cerca de 20 cm de comprimento), se estendendo do assoalho da bexiga até o óstio externo da uretra, localizado na extremidade do pênis. Dessa forma, a uretra masculina faz parte tanto do sistema urinário, conduzindo a urina da bexiga para o meio externo, como do sistema reprodutor masculino, sendo via de passagem para a liberação do sêmen para o meio externo. A uretra masculina pode ser dividida em três regiões anatômicas: 1) parte prostática, que atravessa a próstata e recebe drenagem dos ductos da próstata e dos ductos ejaculatórios do sistema reprodutor; 2) parte membranácea, um segmento curto que atravessa o diafragma urogenital, constituído pelo músculo transverso profundo do períneo; e 3) parte esponjosa, que atravessa o pênis e na qual encontramos a abertura das glândulas bulbouretrais. A parede da uretra masculina também é constituída de uma camada mucosa profunda e uma camada muscular superficial. Na parte prostática, a camada mucosa é formada por epitélio de transição, mas que mais distalmente se torna epitélio estratificado colunar ou pseudoestratificado colunar. A camada muscular é formada por fibras musculares dispostas de forma circular, que colaboram para a formação do esfíncter interno da uretra. A parte membranácea apresenta epitélio estratificado colunar ou pseudoestratificado colunar e camada muscular composta por fibras musculares esqueléticas dispostas de forma circular, oriundas do músculo transverso profundo do períneo, que colaboram para a formação do esfíncter externo da uretra. A camada mucosa da parte esponjosa também é formada por epitélio estratificado colunar ou pseudoestratificado colunar, com exceção da região do óstio externo da uretra, formada por epitélio estratificado pavimentoso não queratinizado.
Agora, que você conheceu as principais características estruturais e funcionais do sistema urinário, você é capaz de compreender a importância do conhecimento desse tema para uma atuação profissional adequada e segura, visando o bem-estar e promoção da saúde.
Vamos Exercitar?
Agora que você conheceu as estruturas do sistema urinário, bem como suas funções, vamos retomar a situação-problema. A partir de agora, vamos considerar que você seja o Daniel, um estagiário da área da saúde na Universidade de sua cidade. Nessa etapa do seu estágio, você acompanhará a equipe multidisciplinar responsável por um Programa de Atenção Integral à Saúde na sua Instituição. Neste primeiro momento, você está acompanhando a análise e discussão de diferentes casos clínicos de pacientes atendidos em uma Unidade Básica de Saúde (UBS) parceira do Programa. Durante uma das reuniões, foi discutido o caso de uma paciente que apresentava os seguintes achados clínicos: dor e ardência ao urinar há três dias, vontade de urinar com maior frequência nas últimas 24 horas, urina com coloração mais escura, mas sem alteração de cheiro, sem presença de febre e outras comorbidades. O exame de urina da paciente mostrou bacteriúria, piúria e hematúria. Assim, diante de todos os achados, a paciente acabou sendo diagnosticada com cistite. Aproveitando o quadro clínico apresentado, seu supervisor do estágio aproveitou para fazer os seguintes questionamentos: “O que é a cistite? Você saberia explicar quais estruturas são acometidas na cistite? Qual a importância dessas estruturas para o funcionamento do nosso organismo?”. Agora, você já é capaz de responder seu supervisor. Vamos lá?
Primeiramente, é importante lembrar que o sistema urinário é composto de rins, ureteres, bexiga urinária e uretra. As funções desse sistema são realizadas principalmente pelos rins. Desse modo, os rins apresentam um papel importante na manutenção do meio interno do organismo, atuando na regulação do volume e da composição do líquido extracelular, regulação do pH do meio interno, excreção de resíduos metabólicos e produtos tóxicos e produção de hormônios (eritropoetina e calcitriol). Assim, alterações na atividade desse sistema podem acarretar o aparecimento disfunções em outros sistemas corporais, comprometendo o funcionamento normal do organismo. Algumas patologias podem estar associadas ao sistema urinário, como as infecções do trato urinário (ITU), caracterizadas por formação de colônias de bactérias, principalmente a Escherichia coli, ou fungos no sistema urinário. As mulheres são mais susceptíveis a esse tipo de infecção devido à proximidade entre o óstio externo da uretra e o ânus. Além disso, a uretra feminina é curta, o que possibilita que bactérias atinjam a bexiga urinária mais facilmente. Os sinais e sintomas dessas infecções incluem disúria, a bexiga torna-se sensível à pressão, urgência urinária, necessidade de urinar com maior frequência (polaciúria), lombalgia e enurese noturna. O exame de urina é geralmente solicitado quando há suspeita de ITU e para indivíduos que apresentam a infecção os achados são bacteriúria, piúria e hematúria. Quando a inflamação acomete a parede da uretra, temos um quadro de uretrite. Porém, se a inflamação atingir a bexiga urinária, temos uma cistite, mas muitas vezes as infecções acabam acometendo as duas regiões (uretra e bexiga). Para o tratamento de uma ITU utiliza-se a terapêutica antibiótica. Caso a infecção não seja tratada, as bactérias podem avançar ascendendo pelo ureter e atingir a pelve renal. Nesse caso, a inflamação é denominada pielite. Havendo o avanço da infecção até o córtex e medula renal, o quadro é chamado de pielonefrite e o indivíduo pode apresentar febre alta, dor intensa do lado envolvido, vômitos e diarreia.
Saiba Mais
Funções do sistema urinário
O sistema urinário desempenha funções que são vitais para o nosso organismo, incluindo a regulação do equilíbrio hídrico, eletrolítico e ácido-base, a remoção de resíduos metabólicos e toxinas, e a regulação da pressão arterial. Além disso, esse sistema contribui para a regulação da osmolaridade e volume sanguíneo. Assim, o sistema urinário exerce funções importantes no nosso organismo, permitindo a manutenção da homeostase corporal e prevenção de doenças renais, garantindo um funcionamento adequado de todo o organismo.
Para saber mais sobre as funções do sistema urinário e a sua importância para o funcionamento do nosso organismo, acesse a seguinte obra:
- O sistema urinário: estruturas e funções. Khan Academy.
Características anatômicas e histológicas do trato urinário
A histologia dos rins, ureteres, bexiga e uretra fornece conhecimentos fundamentais para o entendimento a respeito da estrutura e funções desses órgãos, que incluem filtração e excreção de resíduos metabólicos, regulação do equilíbrio hidroeletrolítico e controle da pressão arterial. Compreender a histologia do sistema urinário é fundamental para auxiliar no diagnóstico e tratamento de distúrbios renais, infecções do trato urinário, cálculos renais e outras condições relacionadas, permitindo um cuidado eficaz e abrangente aos pacientes.
Para saber mais sobre a histologia do sistema urinário, leia a seguinte obra disponível na Biblioteca Virtual:
- ABRAHAMSOHM, P. Sistema urinário. In: JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023. cap. 20, p. 403-418.
Processos renais básicos: filtração, reabsorção e secreção
Os três processos básicos que ocorrem nos néfrons são a filtração, a reabsorção e a secreção. Esses processos garantem a remoção eficaz de resíduos metabólicos e toxinas, a retenção de substâncias essenciais e a regulação da composição química do sangue, contribuindo para a homeostase e saúde geral do organismo.
Para explorar mais sobre esse tema, leia a seguinte obra disponível na Biblioteca Virtual:
- SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017. cap. 19, p. 594-612.
Referências Bibliográficas
CURI, R.; PROCÓPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Aula 2
Função Renal
Função renal
Olá, estudante! Nesta videoaula, você irá conhecer os néfrons, unidades estruturais e funcionais dos rins. Você irá explorar as principais características anatômicas e funcionais dos néfrons, compreendendo sua participação na regulação do equilíbrio hidroeletrolítico do nosso organismo. Você será capaz de compreender processos de formação da urina e depuração renal, entendendo como os rins filtram o sangue, reabsorvem substâncias essenciais e eliminam resíduos metabólicos. Prepare-se para explorar todos os aspectos dos rins e da formação da urina! Aproveite e assista a videoaula agora mesmo!
Ponto de Partida
Nesta aula, você, estudante, irá conhecer a estrutura anatômica do néfron, e como o seu funcionamento auxilia na manutenção da homeostase corporal. Você conhecerá os diferentes segmentos do néfron, quais processos renais básicos ocorrem em cada um desses segmentos e como resultam na formação da urina. Além disso, você compreenderá como ocorre o reflexo da micção e como esse reflexo pode ser controlado consciente e inconscientemente. Assim, você será capaz de reconhecer todas essas características, tornando possível a compreensão e aplicação desses conhecimentos no seu dia a dia profissional. Dessa forma, a partir dos conceitos abordados na seção, você será capaz de identificar as características estruturais do néfron, unidade funcional dos rins, relacionando-as com suas funções e como essas características podem influenciar e contribuir para o bom funcionamento do nosso organismo, sempre fazendo a relação desses conceitos com o seu contexto profissional. Prepare-se para mais essa jornada de conhecimentos! Vamos lá!
A partir de agora, você continuará a acompanhar a rotina de Daniel, um aluno de graduação na área da saúde, que realiza seu estágio junto à equipe do Programa de Atenção Integral à Saúde de sua Universidade. Nessa etapa do estágio, Daniel está acompanhando as discussões de casos clínicos de alguns atendimentos realizados por uma Unidade Básica de Saúde (UBS) parceira do Programa. Durante a discussão dos casos, realizada pela equipe, foi mencionado o caso clínico do paciente J. W. R., sexo masculino, 11 anos. Inicialmente, o menino compareceu, junto de sua responsável, ao Ambulatório da UBS apresentando edema facial, com início há 7 dias, edema nos membros inferiores e aumento do volume abdominal. A responsável relatou que a criança apresentou dor de garganta e febre moderada há três semanas, com melhora sem tratamento medicamentoso. Também referiu que a urina da criança estava “marrom-enferrujada” e “espumosa”. O exame físico mostrou dor à palpação de flancos direito e esquerdo. O exame de urina mostrou hematúria, proteinúria e oligúria. Ultrassom de rins e vias urinárias sem alterações. Diante do quadro clínico apresentado e dos resultados dos exames, a hipótese diagnóstica aventada para o paciente foi de glomerulonefrite pós-estreptocócica. O paciente foi medicado com antibiótico e, ao fim do tratamento, compareceu em consulta de retorno, apresentando-se assintomático e com regressão do edema, recebendo alta ambulatorial. Ainda durante a discussão desse caso clínico, o supervisor do Programa aproveitou para incentivar Daniel a relembrar alguns conceitos importantes a respeito das características anatômicas e funcionais dos diferentes componentes do néfron. Ele fez os seguintes questionamentos a ele: “você saberia explicar o que é uma glomerulonefrite? Que componente estrutural do néfron é acometido nessa patologia? Qual é a importância dessa estrutura para o funcionamento do nosso organismo?”
Como você, no lugar de Daniel, responderia a todos esses questionamentos?
Vamos Começar!
Os rins são responsáveis pela formação da urina, sendo suas camadas formadas por túbulos microscópicos denominados néfrons. Em cada rim, podemos encontrar cerca de um milhão de néfrons, considerados suas unidades funcionais. Aproximadamente 80% dos néfrons estão localizados quase completamente dentro do córtex renal, sendo chamados de néfrons corticais. Os outros 20% penetram na região medular do rim e, por isso, são chamados de néfrons justamedulares. Cada néfron é formado pelo corpúsculo renal e uma estrutura tubular. Esta última é formada por quatro porções denominadas túbulo proximal, alça de Henle, túbulo distal e ducto coletor.
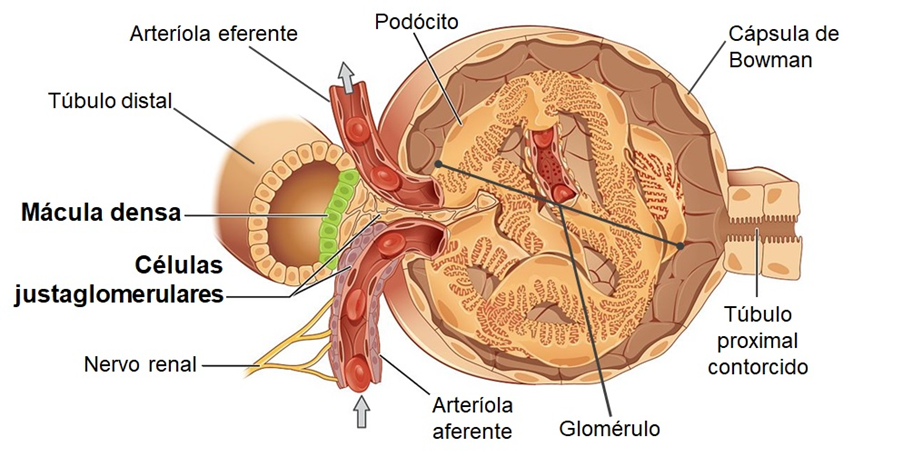
O corpúsculo renal faz parte do néfron, sendo que cada um dos corpúsculos é formado por uma rede de capilares glomerulares chamado glomérulo. Envolvendo o glomérulo encontramos a cápsula de Bowman, uma câmara de parede dupla, com espaço no seu interior (espaço de Bowman) preenchida com líquido (filtrado glomerular). A função do corpúsculo renal é promover a filtração do plasma para dentro dos túbulos renais, a primeira etapa da formação da urina. A partir do momento que o plasma é filtrado para dentro da cápsula de Bowman passa a ser chamado de filtrado glomerular, sendo composto principalmente de água e solutos dissolvidos. O sangue chega em cada glomérulo pela arteríola aferente e, ao fluir pelo glomérulo, parte do plasma acaba sendo filtrado para a cápsula de Bowman. Aproximadamente 20% do plasma que flui ao longo dos rins é filtrado para dentro do néfron, o restante, juntamente com as células sanguíneas e maior parte das proteínas plasmáticas, acaba não sendo filtrado, sendo drenado do glomérulo pela arteríola eferente. A essa porcentagem de volume total do plasma filtrado inicialmente para a cápsula de Bowman e, depois, para o interior dos túbulos renais é dado o nome de fração de filtração.
Para que a filtração ocorra, o plasma precisa atravessar a membrana de filtração do rim antes de alcançar o lúmen tubular. Essa membrana é formada por três barreiras de filtração: o endotélio do capilar glomerular, uma lâmina basal e o endotélio da cápsula de Bowman. Os capilares glomerulares são capilares fenestrados, portanto, apresentam poros grandes entre as células endoteliais que permitem a passagem da maior parte dos componentes do plasma, exceto a passagem de células sanguíneas e proteínas plasmáticas carregadas negativamente. A lâmina basal, segunda barreira de filtração, é uma camada acelular de matriz extracelular, formada por glicoproteínas carregadas negativamente, colágeno e proteoglicanos, localizada entre o endotélio do capilar glomerular e o endotélio da cápsula de Bowman. A lâmina basal impede a passagem da maioria das proteínas plasmáticas. Ainda fazendo parte da membrana de filtração, há o endotélio da cápsula de Bowman. Este envolve cada capilar glomerular, sendo formado por células epiteliais especializadas, denominadas podócitos. Os podócitos apresentam extensões citoplasmáticas chamadas pedicelos, que envolvem os capilares glomerulares e se entrelaçam entre si, formando lacunas, chamadas de fendas de filtração e que impedem a passagem de proteínas e macromoléculas. Após passar pela membrana de filtração, o filtrado glomerular desemboca no espaço de Bowman e, depois, passa para o lúmen do túbulo proximal. Ainda, ao redor e entre os capilares glomerulares, podemos encontrar as células mesangiais. Essas células apresentam elementos contráteis e, dessa forma, participam da regulação do fluxo sanguíneo pelos capilares. Após o filtrado glomerular deixar a cápsula de Bowman, ele flui para o sistema de túbulos renais, sendo modificado ao longo desses túbulos, pelos processos de reabsorção e secreção tubular, para formar a urina. Assim, inicialmente, o filtrado drena da cápsula de Bowman para o primeiro segmento tubular, denominado túbulo proximal, passando a ser chamado de fluido tubular ou urina.
A filtração glomerular é determinada por um gradiente de pressão no corpúsculo renal, denominada pressão efetiva de filtração (PEF). Esta depende da combinação de três pressões: (1) pressão hidrostática do capilar glomerular (PCG, em média, de 55 mmHg): força o movimento do fluido do capilar glomerular para o espaço de Bowman; (2) pressão oncótica do capilar glomerular (πCG, em média, de 30 mmHg): gerada devido à presença de proteínas no plasma. Essa pressão é maior dentro dos capilares glomerulares do que no fluido presente na cápsula de Bowman, favorecendo o movimento do fluido de volta para os capilares. Portanto, é uma força que se opõe à filtração; e (3) pressão hidrostática do fluido na cápsula de Bowman (PCB, em média, de 15 mmHg): o fluido presente no interior da cápsula (espaço de Bowman) gera uma pressão hidrostática desse fluido, que se opõe ao movimento do fluido dos capilares para dentro da cápsula e, portanto, à filtração. A pressão oncótica no interior da cápsula de Bowman é considerada nula, uma vez que a filtração de proteínas é extremamente baixa. Desse modo, a PEF é de, em média, 10 mmHg, do capilar glomerular para o interior da cápsula de Bowman, direção que favorece a filtração. Contudo, conforme o sangue flui ao longo do capilar, a PCG diminui. Isso ocorre devido à resistência ao fluxo, causada pelo comprimento do capilar. Por outro lado, conforme o líquido vai sendo filtrado, a concentração de proteínas aumenta no capilar glomerular, promovendo um aumento da πCG ao longo desse capilar. Mas, mesmo com a diminuição da PCG ao longo do capilar glomerular, esta ainda permanece maior do que as pressões que se opõem a ela, permitindo a filtração ao longo de praticamente todo o comprimento dos capilares glomerulares. O volume de fluido filtrado para o interior da cápsula de Bowman por unidade de tempo é denominado taxa de filtração glomerular. Em um indivíduo adulto, a taxa de filtração glomerular (TFG) é, em média, de 125 mL/min. Considerando o volume plasmático total de cerca de 3 litros, a TFG indica que os rins filtram todo o volume plasmático do nosso corpo aproximadamente 60 vezes por dia. Alguns fatores, como o fluxo sanguíneo renal e a pressão arterial, podem influenciar na TFG. Contudo, embora haja flutuações nesses fatores, a TFG permanece relativamente constante, devido a um controle local exercido pelos rins e que envolve diferentes mecanismos.
A partir de agora, seguiremos o trajeto desse fluido através dos diferentes segmentos tubulares. O próximo segmento do néfron é o túbulo proximal, que apresenta duas porções: uma inicial mais tortuosa, denominada porção convoluta ou contorcida, e uma porção reta, localizada mais no final desse segmento tubular. O túbulo proximal é revestido por epitélio cúbico simples, no qual as células apresentam duas membranas: uma apical ou luminal, voltada para o lúmen tubular e com presença de uma borda em escova com microvilosidades; e uma basolateral, que constitui o limite entre a célula e o interstício e capilares peritubulares. No túbulo proximal, ocorre a maior parte do processo de reabsorção renal, sendo reabsorvidos nutrientes orgânicos, íons e água. A reabsorção da maioria dos solutos nesse segmento está associada a um gradiente de concentração de Na+ entre o filtrado glomerular e o citoplasma das células tubulares dos néfrons. A concentração de Na+ no filtrado que entra pelo túbulo proximal é similar à composição iônica plasmática, uma vez que quase todos os solutos são filtrados do plasma (com exceção das proteínas plasmáticas maiores) para a cápsula de Bowman na mesma proporção que a água. Porém, o filtrado que chega ao túbulo proximal apresenta uma concentração maior de Na+ do que no interior das células tubulares. Assim, a favor do gradiente eletroquímico, o Na+ entra passivamente na célula tubular, via canais de vazamento abertos ou utilizando proteínas transportadoras. Dentro das células tubulares, o Na+ é transportado ativamente através da membrana basolateral pela bomba Na+-K+-ATPase, o que acarreta o movimento do Na+ para o líquido intersticial (LIT) e capilares peritubulares (reabsorção) e entrada de K+ na célula tubular. Como mencionado, o Na+ pode atravessar a membrana apical utilizando proteína transportadora por cotransporte com outras substâncias como glicose, aminoácidos e íons (K+, Ca2+, Cl–, HCO3–, HPO42–). A saída de Na+ e outros solutos do lúmen tubular para o LIT promove uma diluição do fluido tubular e aumento da concentração do LIT, criando um gradiente osmótico que favorece o movimento da água do lúmen tubular em direção ao interstício. Além disso, esse transporte de água gera um gradiente favorável ao transporte de ureia. A saída da água do lúmen tubular resulta em aumento da concentração de ureia no fluido tubular, gerando um gradiente de concentração para o movimento dela do lúmen tubular para o LIT. E, finalmente, no túbulo proximal, acontece a reabsorção da maior parte das proteínas e peptídeos pequenos filtrados através da membrana de filtração. A reabsorção dessas substâncias ocorre geralmente por pinocitose. Assim, aproximadamente 70% da água e solutos filtrados, assim como praticamente toda a glicose e os aminoácidos e frações significativas de íons importantes, acabam sendo reabsorvidos no túbulo proximal. Uma vez no interstício, a água e os solutos se movem para os capilares peritubulares, retornando à circulação sistêmica. Além da reabsorção, no túbulo proximal, também ocorre o processo de secreção. Nesse segmento, substâncias como H+, amônia e vários compostos orgânicos são secretados no lúmen tubular. Esses compostos incluem produtos de degradação metabólica (creatinina e ácido úrico) ou provenientes do meio externo, como os fármacos (anestésicos, antibióticos, morfina, entre outros) e toxinas. Dessa forma, pelo processo da secreção tubular renal, muitas substâncias nocivas acabam sendo eliminadas do corpo. Ao sair do túbulo proximal, o fluido tubular apresenta a mesma concentração do filtrado glomerular e do plasma, uma vez que os solutos e a água são reabsorvidos nas mesmas proporções (processo de reabsorção isosmótica) nesse segmento. Desse local, o fluido tubular segue e adentra a alça de Henle. Esta é um segmento tubular que desce até a medula e, depois, retorna para o córtex, sendo formada por três ramos: descendente fino, ascendente fino e ascendente grosso.
A alça de Henle é responsável pela reabsorção de cerca de 25% de Na+ e Cl- filtrados e 15% de água filtrada. O ramo descendente fino, o primeiro dessa estrutura, é altamente permeável à água. Nesse ramo, a água é reabsorvida por osmose, a favor de um gradiente de concentração gerado pelo interstício circundante hiperosmótico em relação ao fluido tubular. A reabsorção da água ocorre através de canais de água, chamados aquaporinas-1 (AQP1), os mesmos presentes no túbulo proximal e que permitem a reabsorção de água naquele local. No entanto, no ramo fino descendente, não ocorre reabsorção de Na+ e Cl-. Assim, o fluido tubular, ao sair desse ramo, apresenta maior concentração de Na+ e Cl-, devido à reabsorção de água. Nos ramos ascendentes fino e grosso da alça de Henle, não há reabsorção de água, pois esses segmentos não apresentam aquaporinas (AQP), sendo, portanto, impermeáveis à água. Por outro lado, nesses segmentos ocorre a reabsorção de Na+ e Cl-. No ramo ascendente fino, a reabsorção de Na+ e Cl- é passiva, a favor de um gradiente de concentração, uma vez que a chegada do fluido tubular concentrado em solutos, (Na+ e Cl-), oriundo do ramo descendente fino, acaba favorecendo a difusão desses solutos do fluido tubular em direção ao LIT. Além do processo de reabsorção de Na+ e Cl-, no ramo ascendente fino, também se observa a secreção passiva de ureia para o fluido tubular. No ramo ascendente grosso, a reabsorção de Na+ e Cl- é favorecida pela atividade da bomba Na+-K+-ATPase na membrana basolateral das células tubulares, que mantém baixa a concentração de Na+ dentro da célula tubular, gerando um gradiente de concentração que favorece o movimento desse íon do fluido tubular para dentro da célula. O transporte do Na+ e Cl- através da membrana apical da célula para o seu interior ocorre via proteínas transportadoras por cotransporte de 1Na+-1K+-2Cl-, movendo o Na+, Cl- e K+ para dentro da célula. Os K+ acabam sendo reciclados, retornando para o fluido tubular através de canais de potássio presentes na membrana apical. O transporte de Na+ na membrana apical também pode ser realizado por proteínas transportadoras por contratransporte de 1Na+-1H+, movendo Na+ para dentro da célula e H+ para o fluido tubular. Dessa forma, além da reabsorção de Na+ nesse segmento, ocorre também a secreção de H+. Assim, o resultado dos processos que ocorrem nos ramos ascendentes da alça de Henle é um fluido tubular mais diluído em relação ao plasma e ao interstício que envolve esse segmento. Isso acontece porque na alça de Henle ocorre reabsorção de maior quantidade de NaCl do que de água, tornando esse fluido tubular hiposmótico em relação ao plasma e interstício circundante. Como a reabsorção de NaCl acaba sendo o responsável por esse fluido mais diluído e essa reabsorção ocorre no ramo ascendente da alça de Henle, este ramo é então chamado de “segmento diluidor”.
O fluido tubular deixa a alça de Henle e entra no túbulo distal, que pode ser dividido em um segmento inicial, denominado túbulo distal convoluto, e um segmento final, chamado túbulo distal final. O túbulo distal se inicia logo após a mácula densa (um curto segmento do ramo ascendente espesso da alça de Henle formado quando o néfron passa entre as arteríolas aferente e eferente que o suprem), se estendendo até o local em que muitos néfrons se unem e formam um único ducto coletor cortical, o qual penetra na medula renal, originando o ducto coletor medular. Com relação aos processos básicos renais, no túbulo distal convoluto não há reabsorção de água, pois esse segmento é impermeável à água. Contudo, o túbulo distal convoluto reabsorve Na+, Cl- e Ca2+, além de secretar H+ e amônia. Nesse segmento, o transporte de Na+ e Cl- na membrana apical em direção ao interior da célula tubular ocorre por meio de proteínas transportadoras por cotransporte Na+-Cl-. Por ação da bomba Na+-K+-ATPase na membrana basolateral das células tubulares, o Na+ deixa o meio intracelular, movendo-se em direção ao LIT. Já o Cl-, é movido do interior da célula tubular para o LIT por difusão via canais de Cl-. Dessa forma, nesse segmento, o fluido tubular perde solutos sem reabsorção de água, diluindo ainda mais.
Do túbulo distal convoluto, o fluido tubular entra no túbulo distal final e depois nos ductos coletores. Esses dois últimos segmentos do túbulo renal apresentam dois tipos celulares: células principais e células intercaladas. As células principais são responsáveis pela reabsorção de Na+, Cl- e água e também pela secreção de K+. Já as células intercaladas reabsorvem K+ e secretam H+. Nas células principais, a reabsorção de Na+ e a secreção de K+ envolve a atividade da bomba Na+-K+-ATPase, presente na membrana basolateral. Essa bomba promove a captação de K+ a partir do LIT para a célula e movimento do Na+ da célula para o LIT. Com isso, a concentração de Na+ intracelular diminui, gerando um gradiente químico que favorece o movimento do Na+ do fluido tubular para o interior da célula, via difusão por canais seletivos ao Na+, canais do tipo ENac, presentes na membrana apical das células tubulares. A secreção de K+ ocorre por canais específicos para esse íon presentes na membrana apical. Com a saída de Na+ do líquido tubular, este torna-se com voltagem mais negativa, o que favorece a reabsorção passiva de Cl- por via paracelular (entre as células). A quantidade de água reabsorvida nos túbulos distais finais e ductos coletores é variável e dependente da presença de hormônio antidiurético (ADH), que regula a permeabilidade à água nesses segmentos tubulares. O ADH estimula a migração de vesículas presentes no citoplasma das células tubulares dos túbulos distal e ductos coletores em direção à membrana apical e, sua posterior incorporação a essa membrana. As membranas dessas vesículas apresentam agregados de canais de água que são sensíveis ao ADH, chamados aquaporinas 2 (AQP2). Quando as concentrações plasmáticas de ADH estão baixas, as AQP2 são retiradas da membrana apical por endocitose, resultando em pouquíssima reabsorção de água nesses segmentos tubulares e, consequentemente, em um fluido tubular com grande volume e hiposmótico (diurese hídrica). Porém, se as concentrações plasmáticas de ADH estão aumentadas, acaba determinando a incorporação de AQP2 na membrana apical e, consequentemente, maior reabsorção de água nesses segmentos, tornando o fluido tubular hiperosmótico e com menor volume. Dessa forma, a alteração na quantidade de AQP2 incorporada na membrana apical constitui um mecanismo rápido de controle da permeabilidade da membrana à água. Diferentemente, a membrana basolateral desses segmentos não depende da ação do ADH, sendo livremente permeáveis à água. Esta, deixa a célula tubular em direção ao interstício hipertônico por canais de água, chamados AQP3 e AQP4, presentes na membrana basolateral. A secreção de K+ pelas células principais para o fluido tubular é mediada pela atividade da bomba Na+-K+-ATPase na membrana basolateral, que capta o K+ do LIT para o interior da célula. Posteriormente, o K+ deixa a célula em direção ao fluido luminal por difusão via canais de K+ presentes na membrana apical.
Nas células intercaladas, a reabsorção de K+ e secreção de H+ são mediadas pela ação da bomba H+-K+-ATPase, localizada na membrana apical, que movimenta K+ para dentro da célula e H+ para o fluido tubular. A seguir, o K+ se difunde da célula para o LIT via canais de K+ presentes na membrana basolateral. Assim, resumidamente, os túbulos distais e ductos coletores são responsáveis pela reabsorção de aproximadamente 8% de Na+ e Cl- e de uma quantidade variável de água (8 a 17%), além da secreção de quantidades variáveis de K+ e H+. Nesses segmentos, o ADH desempenha um importante papel na quantidade de água presente na urina final. Ao deixar os ductos coletores, o fluido tubular (urina) percorre sequencialmente os cálices renais, pelve renal, ureteres, bexiga urinária, uretra, até alcançar o meio externo.
Siga em Frente...
Depuração plasmática ou clearance renal
É o volume de plasma a partir do qual uma substância específica é totalmente removida por minuto e excretada na urina. A depuração plasmática pode ser utilizada para medir a TFG e, portanto, como um indicativo da função renal. Dessa forma, uma TFG reduzida indicaria um declínio da função renal. A depuração plasmática (D) pode ser calculada pela fórmula:
Assim, quando uma substância é livremente filtrada no corpúsculo renal, não sendo secretada e nem reabsorvida pelo néfron, sua depuração plasmática será igual à sua TFG, pois a quantidade de substância filtrada é igual à quantidade da substância excretada. Um exemplo seria a inulina, um polissacarídeo não fisiológico. Contudo, embora a inulina seja ideal para a avaliação da TFG, sua utilização é tecnicamente difícil e pouco prática, o que a torna pouco adequada para uso rotineiro na prática clínica. Clinicamente, a substância utilizada para a medida da TFG é a creatinina, produto do metabolismo da creatina nos músculos esqueléticos, sendo liberada no sangue em um ritmo constante. A creatinina é livremente filtrada nos corpúsculos renais e não é reabsorvida pelos túbulos renais. Entretanto, essa substância é secretada pelo túbulo proximal, de modo que cerca de 10% da creatinina acaba sendo excretada pela urina, o que levaria a uma superestimação da TFG. Mas, devido a um erro de igual magnitude do ensaio realizado em laboratório, o valor da TFG acaba sendo compensado, validando a sua utilização na prática clínica.
Micção
É a eliminação de urina armazenada na bexiga. Esse processo é um arco reflexo simples sujeito ao controle voluntário e involuntário exercido por centros superiores do encéfalo. Conforme a urina começa a ser armazenada na bexiga, suas paredes se distendem, ativando receptores de estiramento presentes nesse local e que produzem potenciais de ação que são conduzidos por neurônios sensoriais, que fazem parte dos nervos pélvicos, e enviados à região sacral da medula espinal. Nesse local, a informação é integrada, resultando em uma resposta que envolve duas ações. A primeira, é a ativação de neurônios parassimpáticos que inervam a musculatura lisa da parede da bexiga urinária (músculo detrusor), promovendo a contração dessa musculatura. Ao mesmo tempo, os neurônios motores somáticos que inervam o esfíncter externo da uretra são inibidos, promovendo o relaxamento desse esfíncter. A contração da bexiga empurra a urina em direção à uretra, exercendo uma pressão sobre o esfíncter interno da uretra, forçando a abertura desse esfíncter. Conjuntamente, o esfíncter externo da uretra relaxa e se abre, permitindo a passagem da urina para a uretra e, em seguida, para o meio externo. Esse arco reflexo simples é observado principalmente em crianças com idade inferior a 2-3 anos, que ainda não aprenderam a exercer o controle voluntário dos esfíncteres. A partir dessa idade, o indivíduo aprende a controlar a atividade dos esfíncteres (reflexo aprendido), mantendo a micção inibida até que haja o desejo consciente de urinar. Para isso, fibras sensoriais oriundas da parede da bexiga urinária, ativadas pelo enchimento dessa estrutura, enviam potenciais de ação por vias ascendentes espinais a centros presentes no tronco encefálico e córtex cerebral, aumentando o desejo consciente de urinar. Como resposta, por meio de vias descendentes, são enviados potenciais de ação para a região sacral da medula espinal, inibindo o reflexo da micção, ou seja, inibindo as fibras parassimpáticas que inervam a parede da bexiga urinária e aumentando a contração do esfíncter externo da uretra pela ativação dos neurônios motores somáticos que o inervam. Quando o indivíduo decide que é o momento apropriado para urinar (vontade consciente), esses mesmos centros do tronco encefálico e córtex cerebral retiram essa inibição, facilitando o reflexo de micção.
Agora que você conheceu as principais características estruturais e funcionais do néfron e aprendeu sobre o reflexo de micção, você é capaz de compreender a importância do conhecimento e como pode impactar para uma atuação profissional adequada e segura.
Vamos Exercitar?
Agora que você conheceu e aprendeu sobre as principais características anatômicas e funcionais dos componentes do néfron e como acontece o reflexo da micção, vamos retomar a situação-problema. A partir de agora, vamos considerar que você seja o Daniel, estagiário da área da saúde na Universidade de sua cidade. Nessa etapa do seu estágio, você acompanhará a equipe multidisciplinar responsável por um Programa de Atenção Integral à Saúde na sua Instituição. Neste primeiro momento, você está acompanhando a análise e discussão de diferentes casos clínicos de pacientes atendidos em uma Unidade Básica de Saúde (UBS) parceira do Programa. Durante a discussão dos casos clínicos, foi abordado o caso de um paciente que apresentava os seguintes achados clínicos: edema facial e nos membros inferiores, aumento de volume abdominal, dor à palpação dos flancos direito e esquerdo, hematúria, proteinúria, oligúria e ultrassom dos rins e vias urinárias sem alterações. Foi referida dor de garganta e febre moderada três semanas antes, que regrediu sem tratamento medicamentoso. Assim, diante de todos os achados, o paciente acabou sendo diagnosticado com glomerulonefrite pós-estreptocócica. Aproveitando o quadro clínico apresentado, o supervisor do estágio aproveitou para te fazer os seguintes questionamentos: “você saberia explicar o que é uma glomerulonefrite? Que componente estrutural do néfron é acometido nessa patologia? Qual é a importância dessa estrutura para o funcionamento do nosso organismo?”
Agora, você já é capaz de responder o seu supervisor. Vamos lá?
Primeiramente, é importante lembrar que o néfron é a unidade funcional dos rins, sendo cada néfron formado pelo corpúsculo renal e um sistema de túbulos. O corpúsculo renal é formado pelo glomérulo e cápsula de Bowman, enquanto o sistema tubular é composto por quatro porções denominadas túbulo proximal, alça de Henle, túbulo distal e ducto coletor. No corpúsculo renal ocorre o processo de filtração e no sistema de túbulos ao longo do qual o fluido filtrado sofre os processos de reabsorção e secreção, que variam de acordo com a porção desse sistema. A glomerulonefrite é uma inflamação que envolve os glomérulos e pode apresentar diferentes causas, como infecções bacterianas, virais e parasitárias. Um dos tipos de glomerulonefrite é a glomerulonefrite pós-estreptocócica, mais comum em crianças, surgindo entre 7 dias e 12 semanas após uma faringite ou infecção da pele ocasionadas por estreptococos beta-hemolíticos do grupo A. Neste caso, os glomérulos inflamados tornam-se tumefeitos e ingurgitados, comprometendo a função da membrana de filtração, permitindo a passagem de quantidades maiores do que o normal de proteínas plasmáticas (principalmente albumina) e células sanguíneas para o filtrado. Como consequência, observa-se a presença de hemácias (hematúria) e proteínas plasmáticas (proteinúria) na urina. A coloração da urina torna-se “marrom-enferrujada”, devido à presença de hemácias intactas e hemoglobina liberada pelas células hemolisadas, e “espumosa”, por conta da presença de proteínas na urina. Em alguns casos, pode haver retenção de sódio e água, que leva ao edema, explicando o aparecimento de edema facial e de membros inferiores, assim como o aumento da pressão arterial. Geralmente, a patologia não necessita de nenhum tratamento específico, havendo o retorno da função renal ao normal em poucas semanas.
Saiba Mais
Néfrons: estrutura e função
O néfron é a unidade funcional básica dos rins, responsável pela filtração do sangue e pela produção de urina. Consiste em uma série complexa de estruturas, incluindo o corpúsculo renal (glomérulo e cápsula de Bowman) e os túbulos renais (túbulo proximal, alça de Henle e túbulo distal). Sua importância reside na regulação do equilíbrio hídrico e eletrolítico do corpo, na eliminação de resíduos metabólicos e toxinas, na regulação da pressão arterial e na manutenção da homeostase geral. Reforçando a importância do seu funcionamento adequado para a manutenção e sobrevivência do organismo.
Para saber mais sobre a estrutura e funções do néfron, leia a seguinte obra disponível na Biblioteca Virtual:
- TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023. cap. 26, p. 1046-1051.
Processos de formação da urina e depuração renal
A taxa de filtração glomerular (TFG) está sob regulação local nos rins, conhecida como autorregulação da TFG. Esse processo é importante, pois mantem a TFG relativamente constante. O mecanismo exato responsável por essa autorregulação ainda não está totalmente identificado. Porém, parece envolver os seguintes mecanismos: resposta miogênica e retroalimentação ou balanço tubuloglomerular. Você sabe como esses dois mecanismos atuam para manter a TFG quase constante frente a alterações que ocorrem na pressão arterial renal?
Para saber mais sobre esse assunto, leia a seguinte obra disponível na Biblioteca Virtual:
- AIRES, M. M. Fisiologia. 5. ed. Rio de Janeiro: Guanabara Koogan, 2018. cap. 50, p. 743-749.
Micção
O reflexo da micção, ou o ato de urinar, é um processo fisiológico complexo e essencial para o funcionamento saudável do organismo. Esse reflexo é controlado principalmente pelo sistema nervoso autônomo e envolve a coordenação entre o cérebro, a medula espinhal e os músculos do trato urinário. Sua importância reside na eliminação de resíduos metabólicos e toxinas do corpo, mantendo o equilíbrio eletrolítico e hídrico, além de contribuir para a regulação da pressão arterial. Dessa forma, esse reflexo contribui para o bom funcionamento e manutenção do nosso organismo.
Para explorar mais sobre o reflexo da micção, leia a seguinte obra disponível na Biblioteca Virtual:
- SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017, cap. 19, p. 613.
Referências Bibliográficas
CURI, R.; PROCÓPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Aula 3
Papel dos Rins no Controle da Pressão Arterial e Ação dos Diuréticos
Papel dos rins no controle da pressão arterial e ação dos diuréticos
Olá, estudante! Nesta videoaula, você conhecerá o papel dos rins no controle a longo prazo da pressão arterial. Você irá explorar os principais mecanismos envolvidos nessa regulação exercida pelos rins, compreendendo o seu papel crucial na manutenção da pressão arterial. Você será capaz de compreender o funcionamento do sistema renina-angiotensina-aldosterona, entendendo como esse sistema auxilia no controle da pressão arterial a longo prazo. Não perca essa oportunidade de aprimorar seus conhecimentos e assista à videoaula agora mesmo!
Ponto de Partida
Nesta aula, você, estudante, irá conhecer o papel dos rins no controle a longo prazo da pressão arterial. Você conhecerá o funcionamento do sistema renina-angiotensina-aldosterona e compreenderá como esse sistema auxilia na regulação da pressão sanguínea a longo prazo. Além disso, você compreenderá como atuam os diferentes tipos de diuréticos, como cada um interfere diretamente na pressão arterial, podendo ser utilizados no tratamento da hipertensão arterial. Prepare-se para mais essa jornada de aprendizado e descobertas! Vamos lá!
A partir de agora, você irá acompanhar um grupo de alunos de um curso da área da saúde. Nessa semana, como parte das atividades práticas do curso, eles irão vivenciar a rotina do Ambulatório do Hospital de sua Universidade. Assim, durante esse período, os alunos poderão acompanhar o atendimento a pacientes da comunidade realizado pela equipe multidisciplinar do Hospital. No primeiro dia de atividades no Ambulatório, os alunos acompanharam o caso da paciente V. S. N., 59 anos. Ela era hipertensa e fazia seu acompanhamento há dez anos nesse local. Segundo a paciente, seus medicamentos estavam sendo efetivos no controle da pressão arterial. Porém, nas últimas semanas, ela começou a se sentir cansada, com fraqueza e câimbras musculares. No exame clínico, observou-se uma pressão arterial de 140 mmHg/102mmHg. A avaliação laboratorial mostrou concentração plasmática normal de sódio e baixa de potássio, levando à suspeita de uma disfunção da secreção de aldosterona. Assim foram realizados novos exames que mostraram um aumento da concentração plasmática de aldosterona e baixa de renina. Diante dos achados, a paciente foi diagnosticada com hiperaldosteronismo primário. A paciente já utilizava um bloqueador do receptor de angiotensina e o diurético furosemida, sendo indicada a associação da espironolactona para o tratamento inicial, até que se achasse a causa do hiperaldosteronismo primário. Em conversa com o grupo de alunos e a equipe, o supervisor do Ambulatório sugeriu que a hipertensão arterial refratária na paciente parecia ser uma consequência do aumento da secreção de aldosterona. Para incentivar as discussões a respeito do caso apresentado, o supervisor levantou os seguintes questionamentos aos alunos de graduação: “vocês saberiam explicar qual a relação da aldosterona e a hipertensão arterial? Qual a participação dos rins nesse processo? Por que foi associada a espironolactona ao tratamento da paciente? Qual a ação desse fármaco?
Como você, no lugar desses alunos, responderia a todos esses questionamentos?
Vamos Começar!
Os rins, mais especificamente os néfrons, são cruciais para a manutenção da homeostase corporal. Alterações nos processos básicos realizados pelos rins (filtração, reabsorção e secreção) resultam em comprometimento de praticamente todos os órgãos e sistemas corporais. Embora algumas doenças renais tenham sua origem nos rins, distúrbios secundários como diabetes mellitus, hipertensão, obesidade e lúpus eritematoso sistêmico também podem levar ao aparecimento de problemas renais.
Hipertensão arterial
É uma condição caracterizada pela elevação sustentada da pressão arterial (PA), ou seja, PA sistólica maior ou igual a 140 mmHg e/ou PA diastólica maior ou igual a 90 mmHg. A hipertensão arterial é uma doença crônica, multifatorial e, geralmente, assintomática. Contudo, a doença pode evoluir ocasionando alterações estruturais e funcionais em diferentes órgãos e tecidos do nosso corpo, tornando-se um fator de risco para doenças cardiovasculares, doenças renais crônicas e mortes prematuras. Assim, para garantir um fluxo sanguíneo adequado aos diferentes órgãos e tecidos do corpo, bem como evitar danos a essas estruturas com consequente instalação e desenvolvimento de patologias, a PA precisa ser mantida dentro de valores considerados normais.
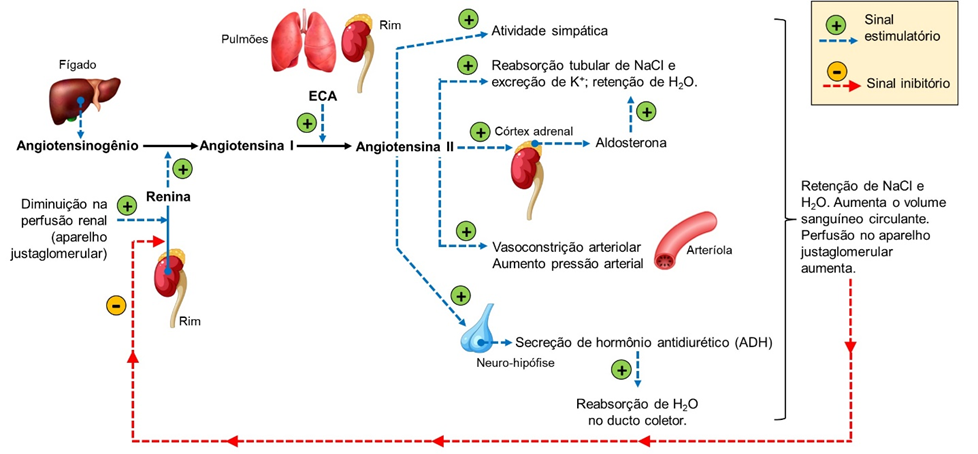
A hipertensão arterial é classificada, de acordo com suas causas, em: hipertensão primária ou hipertensão secundária. A hipertensão primária, também chamada hipertensão essencial não apresenta uma causa específica. Porém, alguns fatores podem contribuir para o seu desenvolvimento, como: idade (mais comum em adultos do que em crianças), sexo e raça (mais prevalente em afrodescendentes), histórico familiar, dieta, níveis plasmáticos de lipídios, tabagismo, etilismo, sedentarismo e obesidade. Já a hipertensão secundária é a elevação sustentada da PA como resultado da presença de outra patologia. Como os rins apresentam um papel predominante no controle da pressão arterial, por meio da regulação do volume dos líquidos corporais, a causa mais comum de hipertensão secundária envolve a diminuição do fluxo sanguíneo renal. Nesse caso, a hipertensão secundária é denominada hipertensão renovascular. A redução do fluxo sanguíneo renal ativa o sistema renina-angiotensina-aldosterona. Como isso acontece nos rins? Para entendermos, precisamos inicialmente conhecer as características anatômicas e funcionais do aparelho justaglomerular. Então, vamos lá!
Nos néfrons, o túbulo distal contorcido encontra-se em contato com o seu respectivo glomérulo e suas arteríolas aferente e eferente correspondentes. Essa unidade, formada por vasos e túbulo, é chamada de aparelho justaglomerular. Na parede do túbulo distal contorcido, parte do aparelho justaglomerular, encontramos as células da mácula densa, que detectam tanto variação de volume do líquido tubular como na sua composição. Já na camada média da arteríola aferente, no lugar do músculo liso, nota-se a presença de células epiteliais chamadas células justaglomerulares ou granulares. No citoplasma das células justaglomerulares, encontramos grânulos contendo a enzima renina, que faz parte do sistema renina-angiotensina-aldosterona.
Na hipertensão renovascular, a diminuição do fluxo sanguíneo renal é detectada pelas células da mácula densa, que enviam essa informação para as células justaglomerulares, estimulando a secreção de renina por essas células. A renina converte o angiotensinogênio plasmático, produzido no fígado, em angiotensina I, que por ação da enzima conversora de angiotensina (ECA), é convertido em angiotensina II. As células justaglomerulares, por sua vez, também são receptores sensíveis ao estiramento (também chamados de barorreceptores intrarrenais) e detectam a redução do estiramento da parede vascular, ocasionada pela diminuição do volume circulatório local. Essa diminuição do estiramento estimula a liberação de renina por essas células e, portanto, a produção de ANG II. Uma das ações exercidas pela ANG II é promover uma forte vasoconstrição que aumenta a resistência periférica total e, consequentemente, a pressão arterial. Outra ação da ANG II é ocasionar o aumento do volume do líquido extracelular, promovendo a retenção de sódio e água pelos rins. A ANG II aumenta a reabsorção de Na+ no túbulo proximal, por estimular o transportador apical Na+- H+. A reabsorção de Na+ no túbulo proximal é seguida pela reabsorção isosmótica de água. A ANG II atua diretamente nas glândulas adrenais, estimulando a síntese e liberação de aldosterona, que aumenta a reabsorção de Na+ no túbulo distal e ducto coletor. E, ainda no ducto coletor, a ANG II estimula os canais de Na+ do tipo ENaC. A ANG II também atua no hipotálamo, estimulando a sede e a secreção de ADH, resultando em aumento da retenção de água, aumento do volume do líquido extracelular e consequente aumento da PA. Assim, diante do exposto, podemos inferir que falhas nos mecanismos de controle da PA, ou seja, na homeostasia, podem acabar levando ao aparecimento da hipertensão arterial.
Siga em Frente...
Diuréticos e suas ações
Os diuréticos são fármacos que atuam sobre os túbulos renais aumentando o volume de urina excretada. A maioria desses fármacos atua inibindo a reabsorção de Na+ e do ânion que o acompanha (principalmente Cl-), promovendo, dessa forma, um aumento da excreção desses íons e, consequentemente, de água. Visto que a reabsorção de água é dependente da reabsorção de solutos, principalmente de Na+. Por suas ações, os diuréticos acabam sendo utilizados para reduzir o volume do líquido extracelular via redução de NaCl corporal. Existem diferentes tipos de diuréticos, classificados de acordo com seus efeitos nos túbulos renais, como:
- Diuréticos de alça: atuam no ramo ascendente espesso da alça de Henle, inibindo a reabsorção de NaCl, mais especificamente, inibindo a atividade do cotransportador 1Na+-1K+-2Cl- presente na membrana apical das células epiteliais desse segmento. A inibição da reabsorção de NaCl resulta em diminuição do potencial positivo do lúmen tubular, comprometendo a reabsorção de cátions divalentes, como Mg+2 e Ca+2, uma vez que o potencial positivo do lúmen é responsável pela reabsorção desses cátions. Como resultado, há o aumento de excreção de Mg+2 e Ca+2. São os agentes diuréticos mais potentes disponíveis, sendo os principais representantes desse grupo de fármacos a furosemida, bumetanida e ácido etacrínico. São indicados principalmente para o tratamento de edema pulmonar agudo, edema periférico e hipercalcemia aguda.
- Diuréticos tiazídicos: atuam no túbulo distal convoluto (contorcido), inibindo a atividade do cotransportador Na+-Cl- na membrana apical das células epiteliais desse segmento e, assim, acarretando diminuição da reabsorção de NaCl. Os diuréticos desse grupo também atuam aumentando a reabsorção de Ca+2. São exemplos de diuréticos tiazídicos a hidroclorotiazida, clorotiazida, metolazona e clortalidona. São utilizados no tratamento da hipertensão, insuficiência cardíaca leve, nefrolitíase ocasionada por hipercalciúria idiopática e diabetes insípido nefrogênico.
- Diuréticos poupadores de potássio: promovem simultaneamente a redução da reabsorção de Na+ e da secreção de K+ no ducto coletor cortical. Para tais efeitos, esses diuréticos atuam inibindo a ação da aldosterona no ducto coletor cortical, como a espironolactona e a eplerenona, ou podem bloquear os canais seletivos ao Na+, canais do tipo ENac, presentes na membrana apical das células tubulares desse local, como a amilorida e o triantereno. A espironolactona é utilizada no tratamento de aldosteronismo, hipopotassemia induzida por outros diuréticos e pós-infarto do miocárdio. Já a amilorida e triantereno são utilizados no tratamento de hipopotassemia induzida por outros diuréticos e síndrome de Liddle.
Agora, que você conheceu o papel dos rins no controle a longo prazo da pressão arterial e como os diuréticos agem para auxiliar nesse controle, você é capaz de compreender a importância do conhecimento desses temas para uma boa atuação profissional.
Vamos Exercitar?
Agora que você conheceu e aprendeu a respeito do papel dos rins no controle a longo prazo da pressão arterial, vamos retomar a situação-problema. A partir de agora, vamos considerar que você faça parte do grupo de alunos de um curso da área da saúde que, nessa semana, irá vivenciar a rotina do Ambulatório do Hospital de sua Universidade, como parte das atividades práticas do curso. No primeiro dia de atividades no Ambulatório, vocês acompanharam o caso da paciente V. S. N., 59 anos. Ela era hipertensa e fazia seu acompanhamento há dez anos nesse local. Segundo a paciente, seus medicamentos estavam sendo efetivos no controle da pressão arterial. Porém, nas últimas semanas ela começou a se sentir cansada, com fraqueza e câimbras musculares. No exame clínico, observou-se uma pressão arterial de 140 mmHg/102mmHg. A avaliação laboratorial mostrou concentração plasmática normal de sódio e baixa de potássio, levando à suspeita de uma disfunção da secreção de aldosterona. Assim foram realizados novos exames que mostraram um aumento da concentração plasmática de aldosterona e baixa de renina. Diante dos achados, a paciente foi diagnosticada com hiperaldosteronismo primário. A paciente já utilizava um bloqueador do receptor de angiotensina e o diurético furosemida, sendo indicada a associação da espironolactona para o tratamento inicial, até que se achasse a causa do hiperaldosteronismo primário. Em conversa com vocês e com a equipe, o supervisor do Ambulatório sugeriu que a hipertensão arterial refratária na paciente parecia ser uma consequência do aumento da secreção de aldosterona. Para incentivar as discussões a respeito do caso apresentado, o supervisor levantou os seguintes questionamentos: “vocês saberiam explicar qual a relação da aldosterona e a hipertensão arterial? Qual a participação dos rins nesse processo? Por que foi associada a espironolactona ao tratamento da paciente? Qual a ação desse fármaco?
Agora, você é capaz de responder a todos esses questionamentos. Vamos lá!
Primeiramente, é importante lembrar que os néfrons são responsáveis pela manutenção do meio interno e que alterações no seu funcionamento resultam em diferentes efeitos fisiológicos que podem ser prejudiciais ao nosso organismo, acarretando o aparecimento de patologias. Você já sabe que alguns fármacos agem nos diferentes segmentos dos néfrons atenuando ou revertendo alterações no volume dos líquidos e eletrólitos corporais, como os diuréticos. Na situação-problema, a paciente apresentava uma hipertensão refratária, ocasionada por um aumento na produção de aldosterona, resultado do hiperaldosteronismo primário. De fato, a aldosterona é um mineralocorticoide produzido e secretado principalmente pela zona glomerulosa do córtex da glândula adrenal. Esse mineralocorticoide atua na regulação do volume corporal, equilíbrio eletrolítico, pressão arterial e do pH dos líquidos corporais. É interessante notar que essas funções da aldosterona estão relacionadas ao seu efeito estimulatório exercido sobretudo sobre as células principais do túbulo distal convoluto e ducto coletor renal, promovendo um aumento na reabsorção de sódio e na secreção de potássio e hidrogênio nesse local. O principal fator fisiológico estimulatório para a secreção de aldosterona é a angiotensina II (ANG II). Assim, baixas quantidades de Na+ que chegam no aparelho justaglomerular estimulam a secreção de renina e, consequentemente, ANG II. Esta atua nas adrenais promovendo a secreção de aldosterona e, dessa forma, completa o sistema renina-angiotensina-aldosterona, que participa da regulação do volume corporal por controlar a retenção renal de Na+. Como consequência, a aldosterona acarreta o aumento do volume do líquido extracelular e da pressão sanguínea. No caso do hiperaldosteronismo primário apresentado pela paciente, mesmo com baixa concentração plasmática de renina, há o aumento da secreção de aldosterona, indicando que esse aumento de secreção não parece estar envolvido com a ação da ANG II, o que também é reforçado pela ausência de correção na concentração de aldosterona quando utilizado o bloqueador do receptor de angiotensina. A furosemida, utilizada no tratamento da paciente, diminui a reabsorção de NaCl, por promover inibição da atividade do cotransportador 1Na+-1K+-2Cl-, localizado na membrana apical das células epiteliais do ramo ascendente espesso da alça de Henle, sem que haja aumento simultâneo na secreção de K+. Devido ao quadro de hiperaldosteronismo, a paciente apresenta diminuição das concentrações plasmáticas de potássio (hipocalemia). Essa redução da concentração de K+ extracelular diminui a excitabilidade dos neurônios, das células cardíacas e células musculares e, se a hipocalemia for grave, pode acarretar paralisia, arritmias cardíacas e morte. Na situação-problema, a paciente apresenta hipocalemia decorrente da ação realizada pela aldosterona. Nos rins, a ação da aldosterona envolve a estimulação da expressão gênica de proteínas responsáveis por aumentar a atividade ou número dos canais do tipo ENac, na membrana apical das células epiteliais do túbulo distal convoluto e ducto coletor, e das bombas Na+-K+-ATPase na membrana basolateral das dessas células, o que promove aumento da reabsorção de Na+ e da secreção de K+. Assim, a espironolactona, um diurético poupador de potássio que atua inibindo a aldosterona no ducto coletor cortical, foi indicado no tratamento da paciente, uma vez que promove simultaneamente a redução da reabsorção de Na+ e da secreção de K+ no ducto coletor cortical e, consequentemente, aumento das concentrações plasmáticas de potássio e diminuição da de sódio, auxiliando na manutenção da pressão arterial e revertendo o quadro de hipocalemia.
Saiba Mais
Conceito de hipertensão arterial
A hipertensão arterial é uma elevação prolongada da pressão arterial, que pode trazer várias consequências graves para o organismo, como danos ao tecido endotelial dos vasos sanguíneos, risco aumentado de doença vascular aterosclerótica e ruptura vascular. Além disso, a pressão arterial alta pode ocasionar danos graves também aos órgãos perfundidos, evidenciando a importância da manutenção da pressão arterial dentro de limites considerados adequados para o corpo.
Para explorar mais sobre a etiologia, patogênese e consequências da hipertensão arterial, leia a seguinte obra disponível na Biblioteca Virtual:
- MEFFORD, L. C. Distúrbios do fluxo sanguíneo e regulação da pressão arterial. In: NORRIS, T. L. Porth: fisiopatologia. 10. ed. Rio de Janeiro: Guanabara Koogan. 2021. cap. 26, p. 741-745.
Sistema renina-angiotensina-aldosterona
Você já se perguntou como nosso corpo regula a pressão arterial a longo prazo para manter a homeostase corporal? Uma das respostas está no fascinante sistema renina-angiotensina-aldosterona. Este sistema desempenha um papel fundamental no controle da pressão arterial a longo prazo e atua promovendo vasoconstrição, reabsorção de água e sódio e estimulando a produção de aldosterona. Entender como esse sistema funciona é essencial para profissionais da saúde, pois fornece informações valiosas sobre os mecanismos fisiológicos por trás da hipertensão arterial e outras condições relacionadas.
Para saber mais sobre o sistema renina-angiotensina-aldosterona, acesse a seguinte obra:
- Visão geral do sistema SRAA – células e hormônios. Khan Academy.
Diuréticos de alça, diuréticos tiazídicos e diuréticos poupadores de potássio
O manitol é um tipo de diurético que só pode ser utilizado por profissionais da saúde em ambiente hospitalar e com indicação médica. É classificado como um diurético osmótico, atuando no túbulo proximal e alça de Henle. Você sabe qual o mecanismo de ação do manitol nesses segmentos tubulares? Quais seriam as indicações clínicas desse diurético?
Para saber mais sobre esse assunto, leia:
- KATZUNG, B. G.; VANDERAH, T. W. Farmacologia básica e clínica. 15 ed. Porto Alegre: AMGH, 2023. cap. 15, p. 275.
Referências Bibliográficas
CURI, R.; PROCÓPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
KATZUNG, B. G.; VANDERAH, T. W. Farmacologia básica e clínica. 15. ed. Porto Alegre: AMGH, 2023.
NORRIS, T. L. Porth: fisiopatologia. 10. ed. Rio de Janeiro: Guanabara Koogan, 2021.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Aula 4
Patologias Associadas ao Sistema Urinário
Patologias associadas ao sistema urinário
Olá, estudante! Nesta videoaula, você irá conhecer as principais patologias associadas ao sistema urinário. Você irá explorar etiologia, patogênese, sinais e sintomas, bem como o tratamento dessas patologias. Você será capaz de compreender como a saúde desse sistema pode ser alterada, comprometendo a homeostasia corporal. Assista à videoaula agora mesmo e embarque nessa jornada de aprendizado e descobertas!
Ponto de Partida
Nesta aula, você, estudante, conhecerá algumas patologias associadas ao sistema urinário. Você conhecerá a etiologia, a patogênese, sinais, sintomas e tratamento das principais doenças que acometem o sistema urinário. Além disso, você compreenderá como essas patologias alteram o funcionamento adequado do sistema urinário, podendo levar ao comprometimento da homeostase corporal. Prepare-se para mais uma oportunidade de aprendizado e descubra como aplicar esses conhecimentos no seu cotidiano profissional! Vamos lá!
A partir de agora, você acompanhará um grupo de alunos de um curso da área da saúde. Nessa semana, como parte de suas atividades práticas, esse grupo de alunos irá acompanhar a rotina do Setor de Hemodiálise do Hospital de sua Universidade. Assim, durante esse período, os alunos poderão acompanhar o atendimento a pacientes renais crônicos e agudos realizado pela equipe multidisciplinar. No primeiro dia de atividades no Setor de Hemodiálise, o diretor responsável pelo setor recebeu os alunos para uma conversa a respeito do tipo de atendimento realizado por eles. Nessa conversa, foi mencionado que além da hemodiálise, esses pacientes também recebiam orientações nutricionais, de higienização, acompanhamento psicológico, além da realização de exercícios físicos acompanhados e individualizados visando sua reabilitação. Assim, segundo o diretor, o setor atuava não somente na realização da hemodiálise, mas também em ações para ajudar os pacientes no enfrentamento da pesada rotina de tratamento, buscando auxiliar na melhora da qualidade de vida dessas pessoas, bem como no tratamento de outras patologias decorrentes da doença renal. Ainda, segundo ele, o setor contava com 20 equipamentos de hemodiálise para atender pacientes internados no Hospital Universitário ou emergências encaminhadas pelo Pronto Socorro, além de pacientes externos que apresentavam comprometimento renal e necessitavam de diálise. Como primeira atividade do grupo de alunos, o diretor sugeriu que eles continuassem o bate-papo discutindo alguns conceitos importantes para o melhor entendimento do tipo de tratamento realizado no setor de hemodiálise. Nesse momento, o diretor levantou os seguintes questionamentos para que os alunos pudessem discutir: “vocês saberiam explicar o que é a hemodiálise? Qual a importância desse procedimento para o bom funcionamento do nosso organismo?
Como você, no lugar desses alunos, responderia a esses questionamentos?
Vamos Começar!
Os rins, mais especificamente os néfrons, são cruciais para a manutenção da homeostase corporal. Alterações nos processos básicos realizados pelos rins (filtração, reabsorção e secreção) resultam em comprometimento de praticamente todos os órgãos e sistemas corporais. Embora algumas doenças renais tenham sua origem nos rins, distúrbios secundários como diabetes mellitus, hipertensão, obesidade e lúpus eritematoso sistêmico também podem levar ao aparecimento de problemas renais.
Cálculo renal
A litíase urinária ou cálculo renal é uma patologia associada ao sistema urinário bastante prevalente. É uma condição bastante comum das vias urinárias, caracterizada pela formação de agregados de cristais de sais presentes na urina e que, ocasionalmente, podem se precipitar, solidificar, tornando-se insolúveis e alojando-se nas diferentes regiões do sistema urinário. São geralmente unilaterais, podendo ser únicos ou múltiplos. Existem quatro tipos principais de cálculos renais: os de sais de cálcio (oxalato de cálcio e fosfato de cálcio), os de ácido úrico, de cistina e os formados por fosfato de amônio e magnésio. Contudo, os cálculos formados de sais de cálcio são os mais comuns na prática clínica. Alguns fatores estão envolvidos na formação dos cálculos renais, como: (1) aumento da concentração sanguínea e urinária dos componentes que constituem os cálculos, como resultado de ingestão excessiva de cálcio ou associados a quadros de hipercalcemia e/ou hipercalciúria (ocasionados por ingestão excessiva de cálcio, distúrbios na absorção tubular de cálcio, acidose tubular, hiperatividade das glândulas paratireoides, bem como presença de alguns tipos de tumor e metástase), dieta rica em purinas ou alterações na absorção tubular de aminoácidos (cálculos de cistina) e doenças como gota (apresentam concentrações altas de ácido úrico na urina); (2) anormalidades anatômicas das estruturas do sistema urinário; (3) presença de infecção no trato urinário (ocasionado por bactérias que decompõem a ureia); e (4) volume urinário baixo (baixo consumo de água). As manifestações clínicas do cálculo renal dependem do seu tamanho, formato e localização. Os cálculos grandes são geralmente assintomáticos, a não ser que estejam associados a obstrução do fluxo urinário e infecções. Cálculos com tamanho variando entre 1 e 5 mm provocam dor de intensidade variável, intermitente, sendo frequentemente acompanhada por náuseas e vômitos. A presença de hematúria é bastante comum, ocasionada pelo traumatismo e ulcerações provocadas pela presença do cálculo renal ou seu deslocamento. Os cálculos podem permanecer ao longo do trajeto do ureter e causar obstrução desse canal e, consequentemente, do fluxo urinário, assim como podem alcançar a bexiga, favorecendo o aparecimento de infecções. Raramente os cálculos se alojam na uretra. A obstrução prolongada das vias urinárias pode acarretar hidronefrose, isquemia, necrose, além de úlceras por compressão exercida pela presença do cálculo renal. O tratamento consiste em analgesia, medicamentos para facilitar a eliminação do cálculo, como bloqueadores de alfa-receptores (p. ex., tansulosina) e, para cálculos persistentes ou que causam infecções, recomenda-se a remoção completa por meio do uso de diferentes técnicas, como a remoção ureteroscópica e a litotripsia extracorpórea por ondas de choque.
Infecção do trato urinário (ITU)
Uma outra patologia bastante prevalente e relacionada ao sistema urinário é a infecção do trato urinário (ITU), considerada uma das causas mais comuns de infecção na população geral. As ITUs podem ser classificadas de acordo com o local node ocorrem no trato urinário. Assim, as ITUs podem ser: 1) inferiores ou baixas, como as infecções na bexiga (cistite), uretra (uretrite) e próstata (prostatite); e 2) superiores ou altas, como as infecções renais (pielonefrites). Devido à possibilidade de ocasionar lesão renal, as ITUs altas são consideradas mais graves. A maior parte dos casos de ITUs é ocasionada por bacilos gram-negativos que residem normalmente no trato intestinal, sendo a mais comum a Escherichia coli. Outros patógenos como Klebsiella pneumoniae, Enterococcus faecalis, Enterobacter spp., Proteus mirabilis e Pseudomonas aeruginosa também podem causar ITUs baixas e altas. As ITUs também podem ser causadas por micobactérias e fungos. E, em indivíduos imunocomprometidos, os vírus também podem ocasionar infecção renal. As ITUs podem ocorrer tanto em crianças como em adultos e a grande maioria é causada por bactérias que entram pela uretra. Embora as bactérias que penetram no trato urinário sejam geralmente expulsas por meio da ação de limpeza da bexiga ao se esvaziar, algumas bactérias podem acabar colonizando a uretra, desencadeando o início de uma ITU. A infecção pode subir da uretra para a bexiga e, algumas vezes, para os rins, ou ambos, agravando o quadro de infecção. Alguns fatores podem influenciar a colonização da uretra, como: infecção urinária prévia, atividade sexual com um novo parceiro e alterações no pH da flora vaginal. Algumas condições podem aumentar o risco de desenvolvimento de uma ITU: obstrução e refluxo urinários, doenças neurogênicas que dificultem o esvaziamento da bexiga, mulheres sexualmente ativas e pós-menopausa, homens com doença prostática e idosos. Procedimentos como cauterização e instrumentação das vias urinarias são fatores que predispõem à ITUs hospitalares. Além da invasão por patógenos pela uretra, os microrganismos podem invadir o organismo pela corrente sanguínea (via hematogênica). Essa via é menos comum e é consequência de semeadura dos rins por bactérias oriunda de focos distantes no curso de septicemia ou infecções localizadas. Geralmente ocorre em indivíduos imunossuprimidos ou recém-nascidos. Os sinais e sintomas clássicos das ITUs incluem disúria, polaciúria, urgência urinária, hematúria e dor pélvica. No entanto, em pacientes idosos ou imunocomprometidos, os sintomas podem ser atípicos, dificultando o diagnóstico preciso e oportuno. O tratamento da ITU depende do patógeno causador, da presença de fatores contribuintes relacionados ao agente etiológico e ao hospedeiro (diabetes, doença autoimune) e se a infecção é aguda ou crônica. Geralmente, o tratamento envolve o uso de antibiótico e ingestão forçada de líquidos.
A insuficiência renal um distúrbio no qual ocorre a perda da função renal, ou seja, os rins perdem a capacidade de filtrar de forma adequada os resíduos metabólicos do sangue, assim como de controlar o conteúdo corporal de água (equilíbrio hídrico) e eletrólitos (sódio, potássio, magnésio, cálcio, fosfato) e pH sanguíneo. A causa da insuficiência renal é bastante variada, podendo envolver doença renal, alterações sistêmicas (como diabetes e pressão alta) ou anormalidades urológicas que não afetam diretamente os rins. Existem dois tipos de insuficiência renal: aguda e crônica.
Siga em Frente...
Lesão renal aguda
A lesão renal aguda (LRA), antes chamada insuficiência renal aguda, é a perda rápida da função renal, levando ao acúmulo de escórias nitrogenadas no sangue (azotemia) e desenvolvimento de distúrbios hidroeletrolíticos. A LRA geralmente é reversível, desde que haja o diagnóstico precoce da lesão, bem como um tratamento adequado. Os tipos de LRA são:
- LRA pré-renal: ocasionada por fatores extrarrenais que levam à diminuição do fluxo sanguíneo renal. Pode ser causada principalmente por perda de volume do líquido extracelular (decorrente de ingestão inadequada de líquidos, hemorragias, diarreia, sepse, entre outros) e diminuição da perfusão renal decorrente de doenças cardiovasculares como insuficiência cardíaca e choque cardiogênico. Observa-se oligúria e aumento das concentrações de ureia no sangue. Em geral, é reversível quando eliminada a causa.
- LRA intrarrenal: ocasionada por distúrbios que levam à lesão de estruturas presentes nos rins. Os distúrbios podem envolver vasos sanguíneos, glomérulos, túbulos renais ou interstício. As principais causas da LRA envolvem: manutenção prolongada de causas pré-renais, ação de nefrotoxinas diretamente sobre os rins (fármacos e contrastes radiográficos) e doenças primárias do parênquima renal, como glomerulonefrites, necrose tubular aguda, nefroesclerose maligna, entre outros).
- LRA pós-renal: resulta da obstrução da drenagem da urina produzida nos rins, podendo ocorrer nos túbulos coletores (hidronefrose intraparenquimatosa), no ureter (cálculos e estenoses), na bexiga (tumores) ou na uretra (hiperplasia prostática).
O tratamento da LRA é baseado na definição e remoção da causa da lesão. Porém, quando não é possível a manutenção sob controle das escórias nitrogenadas e do equilíbrio hidroeletrolítico, geralmente, torna-se necessária a realização de hemodiálise.
Insuficiência renal crônica (IRC)
É a perda da função renal de modo lento e gradativo, resultando em perda irreversível dos néfrons e consequente diminuição progressiva da filtração glomerular, da capacidade de reabsorção tubular e das funções endócrinas dos rins, podendo evoluir para a insuficiência renal. Inicialmente, a IRC é assintomática. Nessa fase há destruição de cerca de 75% dos néfrons funcionantes, porém, os sinais e sintomas não costumam aparecer, pois os néfrons funcionantes remanescentes sofrem hipertrofia e passam a realizar uma hiperfiltração compensatória, o que contribui ainda mais para sobrecarga e lesão renal. Com o aumento progressivo da destruição dos néfrons, instala-se de fato a insuficiência renal. Os rins perdem a capacidade de manter o equilíbrio hidroeletrolítico, há uma redução precoce da capacidade de concentrar a urina e eliminar ureia e creatinina (azotemia), seguida de uremia, retenção da água e sódio, hiperpotassemia, hiperfosfatemia, hipocalcemia, acidose metabólica e anemia. Também podem ocorrer alterações fisiológicas secundárias como hipertensão arterial, insuficiência cardíaca congestiva e edema pulmonar. Assim, inicialmente, na IRC observa-se presença de fadiga, lentidão, anorexia e diminuição da acuidade mental. Mas na IRC mais grave, são observados sintomas adicionais como aumento da pressão arterial, manifestações neuromusculares, hálito urêmico, sedimento urêmico na pele, desnutrição e dispneia. Quando aproximadamente 90% dos néfrons estão perdidos, inicia-se uma fase terminal da doença, denominada doença renal em estágio terminal, que se caracteriza por oligúria e concentrações plasmáticas de escórias nitrogenadas e creatinina ainda mais altas. A IRC pode ser causada por uma variedade de distúrbios que apresentem potencial para ocasionar lesão renal, como a glomerulonefrite crônica, doença renal policística, pielonefrite, hipertensão e diabetes. O tratamento da IRC inclui controle das doenças secundárias e outras complicações, suplementação de bicarbonato de sódio, possível necessidade de restrição de proteína, fosfato, potássio e sal na dieta, bem como na ingestão de água. Dependendo do estágio da IRC são indicados tratamentos como hemodiálise e transplante renal.
Hemodiálise
A hemodiálise consiste em um processo que remove (filtra) resíduos, toxinas e excesso de líquido do sangue em pacientes com insuficiência renal aguda ou crônica, restaurando o equilíbrio eletrolítico, uma vez que nesses casos os rins não conseguem mais desempenhar essas funções com eficiência. Dessa forma, esse procedimento auxilia mantendo a homeostasia corporal. Na hemodiálise, o sangue do paciente é retirado de uma artéria por meio de um acesso vascular, como um cateter ou uma fístula arteriovenosa, e é então conduzido por um tubo até um dialisador, também conhecido como filtro. O dialisador apresenta dois compartimentos, um para o sangue e outro para o dialisado (composto por água e eletrólitos), separados por uma membrana semipermeável. No dialisador, o sangue entra em contato com a membrana semipermeável que permite a passagem de pequenas moléculas, como ureia e creatinina, mas retém células sanguíneas e proteínas. Assim, enquanto o sangue circula pelo dialisador, o dialisado é introduzido para remover os resíduos e o excesso de fluidos do sangue e, após passar pelo dialisador, o sangue limpo é devolvido ao corpo do paciente por meio de uma outra via vascular.
Agora que você conheceu as principais patologias associadas ao sistema urinário, você é capaz de compreender a importância do conhecimento desse tema para uma atuação profissional adequada e segura, visando o bem-estar e promoção da saúde.
Vamos Exercitar?
Agora que você conheceu e aprendeu a respeito de algumas das principais patologias que acometem o sistema urinário, vamos retomar a situação-problema. A partir de agora, vamos considerar que você faça parte do grupo de alunos de um curso da área da saúde que, nessa semana, irá vivenciar a rotina do atendimento a pacientes renais crônicos e agudos realizado pela equipe multidisciplinar do Hospital de sua Universidade. No primeiro dia de atividades no Setor de Hemodiálise, o diretor responsável pelo setor recebeu o seu grupo para uma conversa a respeito do tipo de atendimento realizado no local. Nessa conversa, foi mencionado que além da hemodiálise, esses pacientes também recebiam orientações nutricionais, de higienização, acompanhamento psicológico, além da realização de exercícios físicos acompanhados e individualizados para visando sua reabilitação. O diretor também comentou que o setor também realizava ações para ajudar os pacientes no enfrentamento da pesada rotina de tratamento, buscando auxiliar na melhora da qualidade de vida desses pacientes, bem como no tratamento de outras patologias decorrentes da doença renal. Ainda, segundo o diretor, o setor contava com 20 equipamentos de hemodiálise para atender pacientes internados no Hospital Universitário ou emergências encaminhadas pelo Pronto Socorro, além de pacientes externos que apresentavam comprometimento renal e necessitavam de diálise. Como primeira atividade do seu grupo, o diretor sugeriu que vocês discutissem sobre alguns conceitos importantes para o melhor entendimento do tipo de tratamento realizado no setor de hemodiálise. Nesse momento, o diretor levantou os seguintes questionamentos a vocês: “Vocês saberiam explicar o que é a hemodiálise? Qual é a importância desse procedimento para o bom funcionamento do nosso organismo?
Agora você é capaz de responder a todos esses questionamentos. Vamos lá!
Primeiramente, é importante lembrar que os processos de filtração, reabsorção e secreção renal são responsáveis pela eliminação de produtos metabólicos e substâncias nocivas ao organismo, bem como ao retorno à circulação sistêmica de substâncias fundamentais ao bom funcionamento dos sistemas corporais, como glicose, água e vários íons. Alterações nesses processos podem resultar em diferentes efeitos fisiológicos que podem ser prejudiciais ao nosso organismo. Doenças ou lesões renais podem alterar esses processos e, nesse caso, as funções renais precisam ser suplementadas ou substituídas por um processo artificial chamado diálise. Esse método se baseia na difusão de solutos através de uma membrana seletivamente permeável. Um dos métodos de diálise é a hemodiálise, procedimento no qual o sangue do braço é direcionado para uma membrana de diálise, que apresenta poros que permitem a passagem de pequenos solutos, localizada dentro de um aparelho chamado dialisador. Ao redor dessa membrana é bombeado um líquido, denominado dialisado, que mantém um gradiente de difusão e, dessa forma, o sangue do indivíduo que flui através dessa membrana é filtrado e as escórias metabólicas e os eletrólitos e líquidos em excesso são removidos, bem como substâncias necessárias ao organismo são adicionadas a ele. Também é adicionado um anticoagulante para evitar que haja a coagulação do sangue que está sendo depurado dentro do dialisador. Após passar pela membrana semipermeável, o sangue depurado flui através de um detector de êmbolos de ar, para a remoção de ar que possa estar presente nesse sangue e, em seguida, o sangue retorna ao corpo do indivíduo. Todo esse processo pode durar de 3 a 5 horas e, dependendo do caso, deve ser feito três vezes por semana.
Saiba Mais
Infecções do trato urinário
A infecção urinária é uma condição comum que afeta milhões de pessoas em todo o mundo. É essencial reconhecer a importância do seu diagnóstico precoce, uma vez que, se não tratada adequadamente, pode levar a complicações graves, como pielonefrite e sepse, podendo levar o indivíduo ao óbito. A prevalência da infecção urinária na população é significativa, principalmente em mulheres, devido principalmente à anatomia feminina. Contudo, outros fatores podem estar associados à ocorrência de infecção urinária na população. Portanto, compreender os sinais e sintomas, bem como buscar tratamento adequado, é crucial para garantir o bem-estar e a saúde do paciente.
Para saber mais sobre as infecções urinárias, leia a seguinte obra disponível na Biblioteca Virtual:
- UMBERGER, R. A.; MEFFORD, L. C. Distúrbios da função renal. In: NORRIS, T. L. Porth: fisiopatologia. 10. ed. Rio de Janeiro: Guanabara Koogan, 2021. cap. 33, p. 991-995.
Cálculos renais
Vários fatores estão envolvidos na formação dos cálculos renais, como baixa ingestão de água, histórico familiar, distúrbios metabólicos (excesso de ácido úrico ou de cálcio) e até mesmo alguns tipos de alimentos. Você sabia que a restrição dietética pode auxiliar na prevenção de formação de cálculo renais? Que alimentos devem ser evitados?
Para saber mais sobre a etiopatogenia e manifestações clínicas dos cálculos renais, leia:
- UMBERGER, R. A.; MEFFORD, L. C. Distúrbios da função renal. In: NORRIS, T. L. Porth: fisiopatologia. 10. ed. Rio de Janeiro: Guanabara Koogan, 2021. cap. 33, p. 988-990.
Insuficiência renal e hemodiálise
A hemodiálise é um procedimento fundamental para pacientes com insuficiência renal crônica, pois substitui a função dos rins, filtrando resíduos e fluidos indesejados do sangue. Dependendo da gravidade da doença renal, as sessões de hemodiálise podem ser realizadas três a quatro vezes por semana. Embora seja essencial para a sobrevivência do portador de doença renal grave, a hemodiálise pode causar efeitos colaterais, como hipotensão e fadiga. Contudo, apesar dos desafios, é uma intervenção essencial para controlar a pressão arterial, equilibrar eletrólitos e prevenir complicações graves associadas à insuficiência renal. Com avanços tecnológicos, os cuidados com hemodiálise continuam sendo aprimorados, oferecendo esperança e qualidade de vida aos pacientes.
Para saber mais sobre a hemodiálise, leia a seguinte obra:
- Hemodiálise. Sociedade Brasileira de Nefrologia.
Referências Bibliográficas
KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10. ed. Rio de Janeiro: Guanabara Koogan, 2023.
NORRIS, T. L. Porth: fisiopatologia. 10. ed. Rio de Janeiro: Guanabara Koogan, 2021.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Encerramento da Unidade
Anatomofisiologia e Patologia do Sistema Urinário
Videoaula de Encerramento
Olá, estudante! Nesta videoaula, você irá continuar a jornada fascinante pelo sistema urinário, explorando conceitos essenciais que são fundamentais para a sua prática profissional. Você já desvendou vários mistérios que envolvem esse sistema, seus componentes e seu funcionamento, e mergulhou no estudo das patologias que podem acometer esse sistema. Agora convido você a continuar nessa jornada! Assista à videoaula e descubra como o conhecimento sobre o sistema urinário pode enriquecer e transformar a sua prática profissional. Não perca!
Ponto de Chegada
Para desenvolver a competência desta unidade, que é “ilustrar conhecimento da anatomia e fisiologia do sistema urinário, identificando como funcionam os mecanismos de eliminação e reabsorção de compostos pelo néfron. Conhecer como agem as principais famílias de fármacos diuréticos utilizadas no mercado e doenças associadas ao sistema urinário”, você primeiramente conheceu os conceitos fundamentais sobre a estrutura e o funcionamento dos rins e vias urinárias. Compreendeu como cada estrutura contribui para o funcionamento adequado do sistema urinário e como as características histológicas influenciam nas suas funções. Além disso, você explorou os processos de filtração, reabsorção e secreção nos néfrons, bem como a regulação da excreção de substâncias pelo sistema urinário. Você também conheceu as principais famílias de fármacos diuréticos, compreendendo seus mecanismos de ação. Por fim, você relacionou todos esses conhecimentos com as principais patologias associadas ao sistema urinário, como infecções do trato urinário, cálculos renais e insuficiência renal. Assim, a abordagem desses assuntos ao longo da unidade permitiu consolidar seu entendimento a respeito do tema e o incentivou a refletir sobre os assuntos abordados e como aplicar esses conhecimentos em contextos práticos.
Reflita
|
É Hora de Praticar!
Nesse momento, você irá acompanhar a rotina de um aluno de graduação na área da saúde, que realiza seu estágio junto à equipe do Programa de Atenção Integral à Saúde de sua Universidade. O Programa conta com uma equipe multidisciplinar e, nessa etapa do estágio, o aluno de graduação continua acompanhando as discussões de casos clínicos de alguns atendimentos realizados no Pronto Socorro do Hospital de sua Universidade. Durante uma das reuniões realizadas pela equipe, foi discutido o caso clínico do paciente W. T. S., 41 anos, que procurou o serviço de emergência do Hospital com dor forte no flanco direito que irradia para a região inguinal direita, acompanhada de náusea e vômito. Segundo o paciente, a dor era constante e aumentava em ondas. Ele também se queixou da presença de sangue na urina, sem febre. Paciente enquadra-se no perfil de síndrome metabólica, apresentando obesidade, hipertensão, hiperlipidemia e resistência à insulina. Devido à obesidade, ele evita carboidratos e consome grande quantidade de carne e frutos do mar. Raramente consome frutas e vegetais. Não tem hábito de ingerir líquidos, exceto durante as refeições. O exame de urina mostrou hematúria microscópica, presença de cristais, baixo pH e hiperuricosúria. A ultrassonografia abdominal constatou a presença de cálculo renal localizado no ureter direito. O paciente recebeu quantidade grande de líquidos por via endovenosa, para auxiliar na eliminação do cálculo, e anti-inflamatório não esteroide (AINEs) para alívio da dor. Após a eliminação do cálculo, foi realizada análise laboratorial, confirmando que se tratava de um cálculo renal de ácido úrico. Ainda durante a discussão desse caso clínico, o supervisor do Programa aproveitou para instigar o estagiário a relembrar alguns conceitos importantes a respeito da fisiopatologia do cálculo renal e fatores de risco associados. Ele fez os seguintes questionamentos ao estagiário: “você saberia explicar o que predispõe o desenvolvimento do cálculo renal? Qual é a relação dos achados laboratoriais e a formação do cálculo renal na paciente? Existe relação entre a síndrome metabólica e a formação de cálculo de ácido úrico?”
Reflita
Como você, no lugar do estagiário, responderia a todos esses questionamentos?
Resolução do estudo de caso
Primeiramente, é importante lembrar que os rins são essenciais para a manutenção da homeostase corporal e que alterações na sua atividade podem acarretar o aparecimento de disfunções não somente em sua própria estrutura, mas também em outros sistemas corporais, comprometendo o funcionamento normal do organismo. Algumas patologias podem estar associadas ao sistema urinário, como os cálculos renais, os quais são agregados policristalinos que se formam a partir de substâncias normalmente excretadas pelos rins, mas que se tornam supersaturadas nesse fluido. Além disso, outros fatores como presença de infecção, pH e estase influenciam no desenvolvimento de cálculos renais. Alguns fatores de risco também podem estar associados e favorecer a formação desses cálculos, como: baixa ingestão hídrica, dieta, anormalidades anatômicas do sistema urinário, distúrbios metabólicos, história familiar e medicações. No caso da paciente citada, existem vários fatores que favorecem a formação do cálculo de ácido úrico. A paciente apresenta algumas condições (obesidade, hipertensão, resistência à insulina e hiperlipidemia) que a enquadram em um perfil de pessoa com síndrome metabólica. A obesidade, particularmente associada à síndrome metabólica, tem sido associada à redução do pH urinário. Nesses pacientes, ocorre uma diminuição da excreção dos íons amônio na urina e consequente redução do tamponamento de H+, diminuindo o pH urinário. A dieta rica em proteínas de origem animal também contribui para a redução do pH da urina, devido à geração de prótons durante a oxidação de radicais sulfurados presentes na proteína animal, principalmente na carne vermelha. Além disso, carnes e frutos do mar são alimentos ricos em purinas, precursoras do ácido úrico. Desse modo, a dieta rica em proteína animal contribui para um aumento da concentração de ácido úrico na urina. O pH ácido da urina contribui para a formação de cálculos de ácido úrico, pois aumenta a conversão de urato a ácido úrico. Assim, a grande produção metabólica de ácido úrico observada na paciente associada ao pH baixo urinário, que também favorece a formação dessa substância, resulta em uma urina com grandes quantidades de ácido úrico, que é insolúvel e, portanto, forma o cálculo. Ainda, uma ingestão baixa de líquidos, resultando em volume urinário baixo, acaba promovendo o aumento da saturação de solutos como o ácido úrico, cálcio, fosfato e oxalato na urina, sendo mais um fator que contribui para a formação do cálculo renal. A hematúria está associada à migração do cálculo pelo ureter. Já as náuseas e vômitos estão associados à intensidade da dor.
Dê o play!
Assimile
Você está convidado a embarcar a partir de agora na jornada fascinante pelo sistema urinário, explorando as informações ricas e instigantes presentes neste infográfico. Aprecie e aproveite as informações sobre os processos de reabsorção e secreção de algumas substâncias no néfron e locais de ação dos diuréticos nessa estrutura! Vamos lá?!
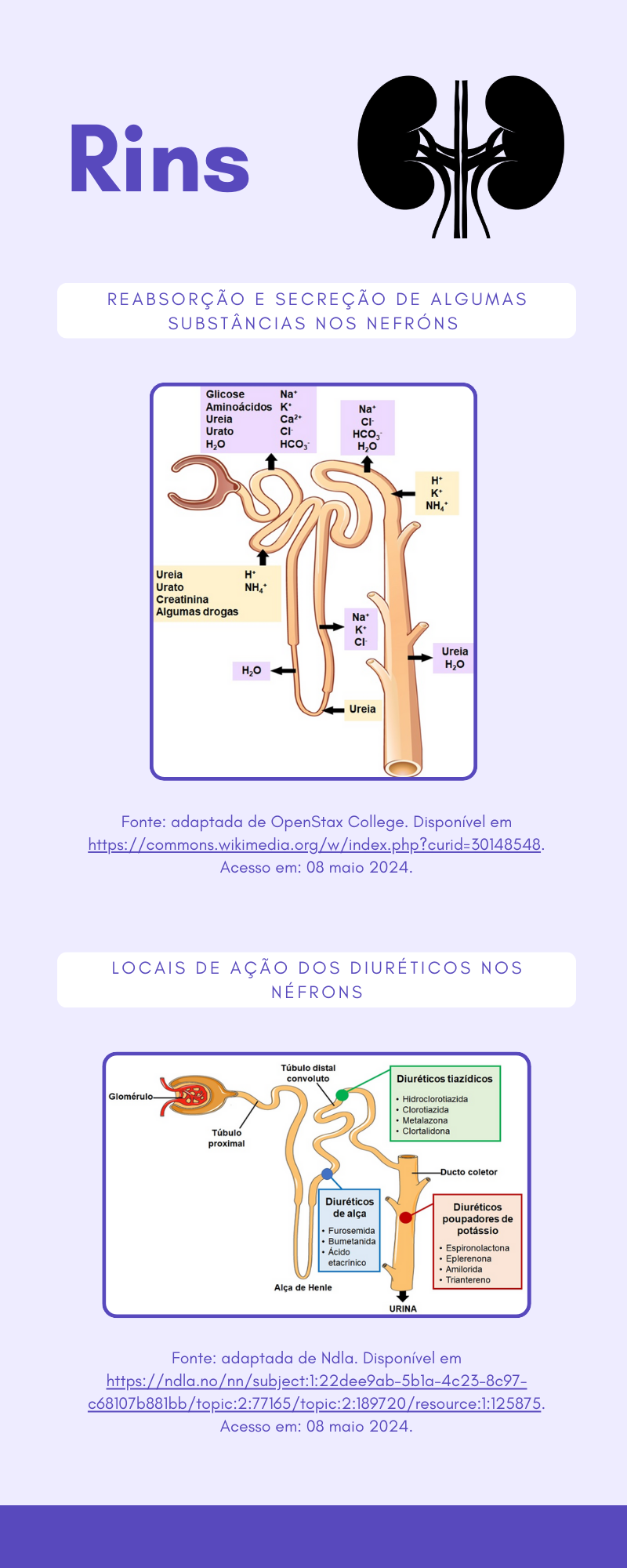
Referências
CURI, R.; PROCÓPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.