Anatomofisiologia e Patologia das Glândulas Endócrinas
Aula 1
Glândula Tireoide
Glândula tireoide
Olá, estudante! Nesta videoaula, você continuará a conhecer o sistema endócrino. Você irá explorar as principais características anatômicas, histológicas e funcionais da glândula tireoide. Ao final da aula, você será capaz de compreender a estrutura microscópica dessa glândula, quais hormônios ela produz, quais seus efeitos biológicos e quais patologias podem estar associadas a ela. Prepare-se para explorar a complexidade da glândula tireoide, aprimorando suas habilidades e ampliando sua compreensão sobre a fisiologia endócrina! Vamos lá!
Ponto de Partida
Nesta aula, você, estudante, continuará a conhecer o sistema endócrino, mais especificamente a glândula tireoide. Você conhecerá quais são suas principais características anatômicas e histológicas. Além disso, você será capaz de compreender quais são os hormônios produzidos pela tireoide, como são produzidos e regulados e quais são as suas funções no nosso organismo. Por fim, você irá explorar as doenças associadas a essa glândula, proporcionando uma visão abrangente e prática para desafios enfrentados na sua prática profissional. Assim, você também vai compreender como os hormônios tireoidianos podem influenciar e contribuir para o bom funcionamento do nosso organismo e a importância desses conceitos no seu contexto profissional. Prepare-se para mergulhar nesse universo fascinante de conhecimento! Vamos lá!
A partir de agora, você irá acompanhar o caso de Carolina. Ela tem 35 anos e sempre foi ativa e cheia de energia. No entanto, nos últimos meses, ela tem sentido uma mudança significativa em sua saúde e bem-estar. Seus dias agora são dominados por uma constante sensação de cansaço e fadiga, mesmo depois de uma noite de sono aparentemente boa. Essa fadiga persistente dificulta suas atividades diárias, como trabalhar e até mesmo brincar com seus filhos. Além disso, Carolina percebeu que ganhou peso inexplicavelmente, apesar de não ter mudado sua dieta ou rotina de exercícios, e também notou que sua pele está mais seca do que o normal, principalmente nas mãos e nos pés, o que causa desconforto e coceira. Ela também tem percebido um leve inchaço no pescoço. Preocupada com esses sintomas que têm impactado profundamente nas suas atividades diárias, Carolina decide procurar ajuda médica. Após uma avaliação clínica detalhada e realização de exames laboratoriais, Carolina é diagnosticada com hipertireoidismo. Seu médico comenta que todos os sintomas que ela apresenta são consequência de uma alteração na glândula tireoide e que, como não tem cura, ela precisará fazer reposição hormonal com levotiroxina por toda vida. Carolina ainda atordoada com a informação e sem entender direito o que realmente tem, pergunta ao médico: “o que é o hipotireoidismo? O que pode causar essa doença? Por que eu preciso fazer reposição hormonal? Tem alguma outra coisa, além da medicação, que posso fazer para auxiliar no tratamento do hipotireoidismo?”
Como você, no lugar do médico, responderia a todos esses questionamentos?
Vamos Começar!
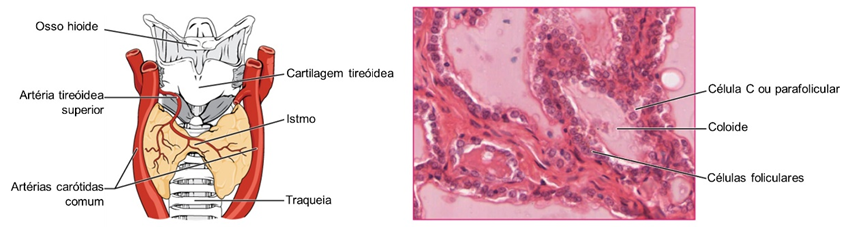
A glândula tireoide é uma glândula endócrina localizada na região cervical, anteriormente à traqueia. A tireoide é altamente vascularizada e composta por dois lobos unidos por um istmo. Observando sua a estrutura, nota-se a presença de inúmeros sacos esféricos denominados folículos tireoideanos. Esses folículos são revestidos por uma camada única de células epiteliais cuboides e seu interior é preenchido por material gelatinoso denominado coloide. O coloide é composto de grande quantidade da proteína tireoglobulina, sintetizada pelas células foliculares. As moléculas de tireoglobulinas são responsáveis por armazenar as moléculas precursoras dos hormônios produzidos pela tireoide, a triiodotironina (T3) e a tiroxina (T4). Além dos folículos, a tireoide também apresenta células parafoliculares ou células C, presentes no espaço entre os folículos, responsáveis pela síntese do hormônio calcitocina, envolvido na regulação das concentrações de cálcio no sangue.
A síntese dos hormônios tireoidianos, T3 e T4, ocorre dentro dos folículos tireoidianos e envolve várias etapas. Ela se inicia com a captação de iodo, por transporte ativo, via cotransportador de sódio/iodo, que promove o transporte de um íon iodeto (I-) para o interior da célula, juntamente com dois íons sódio. Dessa forma, o I- é transportado da corrente sanguínea para o citosol das células foliculares. Ao mesmo tempo, as células foliculares sintetizam tireoglobulinas e enzimas, que são empacotadas em vesículas e secretadas no centro do folículo, para posteriormente serem utilizadas na síntese dos hormônios tireoidianos. À medida que o I- entra no coloide, a enzima tireoide peroxidase promove sua oxidação, facilitando a adição desse iodo à molécula de tirosina, formando a monoidotirosina (MIT) e, em seguida, novo iodo é adicionado a essa molécula, formando a di-iodotirosina (DIT). Uma MIT se combina com uma DIT, formando o hormônio tri-iodotironina ou T3, enquanto duas DIT se combinam para formar o hormônio tetraiodotironina ou tiroxina (T4). Quando a síntese hormonal está completa, o complexo T3/T4 ligado às tireoglobulinas são recaptados pelas células foliculares por endocitose. A tireoglobulina sofre ação de enzimas presentes no interior das células foliculares, liberando T3 e T4, que são transportados para o líquido intersticial e, em seguida, para o sangue. Os hormônios tireoidianos secretados pela tireoide circulam no sangue combinados a proteínas transportadoras, principalmente ligados a globulina transportadora de tiroxina (TBG). Aproximadamente 75% dos hormônios tireoidianos produzidos corresponde a T4 e 25% ao T3. Porém, a maior parte do T4 circulante sofre o processo de desiodação (remoção de um iodo) nos tecidos-alvo, promovido por enzimas denominadas desiodinases. resultando na produção de T3 que, assim, passa a circular no sangue. Esse processo de produção extratireoidiana de T3 contribui para a manutenção da concentração deste hormônio no sangue. Hoje é sabido que o T3 é de 3 a 5 vezes biologicamente mais ativo que o T4, sendo considerado o hormônio ativo na célula-alvo.
A síntese e secreção dos hormônios tireoidianos é regulada pelo sistema de feedback hipotalâmico-hipofisário-tireóideo. Nesse sistema, o hormônio liberador de tireotrofina (TRH), produzido por neurônios hipotalâmicos, que são liberados no sistema porta-hipofisário e chegam na adeno-hipófise, estimula os tireotrofos a produzir e secretar o hormônio tireoestimulante ou tireotrofina (TSH). O TSH, ao ser liberado na corrente sanguínea, alcança a tireoide, estimulando a síntese e liberação de T3 e T4 no sangue, para que alcance seus tecidos-alvo e se liguem a receptores específicos presentes no núcleo das células-alvo. Os hormônios tireoidianos atuam por retroalimentação negativa (ou feedback negativo) sobre os tireotrofos na hipófise e também sobre os neurônios hipotalâmicos responsáveis pela produção de TRH. Desse modo, os hormônios tireoidianos inibem a liberação de TRH e TSH, evitando hipersecreção de T3 e T4. O aumento da concentração plasmática dos hormônios tireoidianos resulta em maior inibição da secreção de TRH e TSH, o que leva à diminuição da secreção hormonal tireoidiana. Em contrapartida, a redução das concentrações plasmáticas dos hormônios tireoidianos acarreta menor inibição da secreção hipofisária de TSH e hipotalâmica de TRH, promovendo estimulação da função tireoidiana e elevação da concentração plasmática de T3 e T4.
Os hormônios tireoidianos, T3 e T4, desempenham inúmeras funções essenciais no nosso organismo. São os principais reguladores da taxa metabólica basal (TBM, quantidade mínima de energia necessária para manter as funções vitais do corpo em repouso). Atuam aumentando a taxa metabólica basal e, consequentemente, a produção de energia. Quando a TMB aumenta, o metabolismo celular de carboidratos, proteínas e lipídios também aumenta. Os hormônios tireoidianos influenciam o metabolismo de carboidratos, aumentando a produção hepática de glicose, que aumenta a liberação de glicose no sangue. Outra ação no metabolismo de carboidrato envolve o aumento a utilização de glicose pelas células. Os hormônios tireoidianos afetam o metabolismo de lipídios, incluindo a síntese, mobilização e oxidação de ácidos graxos. Também estimulam a síntese e catabolismo do colesterol, auxiliando na regulação de suas concentrações no sangue. No metabolismo de proteínas, estimulam tanto síntese (maior efeito) quanto catabolismo desses nutrientes, sendo seus efeitos mais evidentes no tecido muscular esquelético, principal depósito de proteínas do corpo. Além disso, são fundamentais para a manutenção da temperatura corporal, pois aumentam a produção de calor no corpo, ajudando a manter uma temperatura interna estável. Apresentam efeitos permissivos sobre a ação das catecolaminas (adrenalina, noradrenalina), potencializando as ações das catecolaminas. Outra ação dos hormônios tireoidianos é sobre o desenvolvimento do sistema nervoso, promovendo a formação de sinapses, produção de mielina e crescimento de dendritos.
Siga em Frente...
A deficiência de hormônios tireoidianos durante o desenvolvimento fetal ou após o nascimento acarreta grave deficiência intelectual e restrição de crescimento ósseo, resultando em uma síndrome denominada hipotireoidismo congênito. Isso ocorre porque o T3 é necessário para a produção normal do hormônio do crescimento pela adeno-hipófise. Além disso, como comentado anteriormente, o T3 é um hormônio muito importante para o desenvolvimento do sistema nervoso. Assim, sua ausência resulta no desenvolvimento deficiente do sistema nervoso e por grave comprometimento da função intelectual (retardo mental). A causa mais comum de hipotireoidismo congênito está relacionada com a deficiência nutricional de iodo na mãe. Uma vez que esteja ausente na dieta da mãe, não haverá iodo disponível para o feto. Como consequência, embora a glândula tireoide do feto possa ser normal, ela se torna incapaz de sintetizar hormônios tireoidianos em quantidade suficiente. Se a condição for detectada e corrigida com a administração de iodo e de hormônio tireoidiano pouco depois do nascimento, é possível prevenir as anormalidades mentais e físicas. Contudo, caso o tratamento não seja iniciado no período neonatal, o comprometimento intelectual resultante não pode ser revertido. Atualmente, o hipotireoidismo congênito é muito raro, uma vez que a disponibilidade de produtos com sal iodado praticamente eliminou essa síndrome em muitos países. No entanto, ela continua sendo um distúrbio comum em algumas partes do mundo onde não há disponibilidade de sal iodado. O hipotireoidismo congênito pode ser identificado por meio do teste do pezinho. Assim, o hipotireoidismo é uma condição na qual há uma hipoatividade da glândula tireoide, resultando em uma produção insuficiente de hormônios tireoidianos. Quando ocorre em crianças maiores e adultos, causa redução dos processos metabólicos corporais e mixedema (edema duro que se apresenta com aspecto de pele opaca, devido ao acúmulo de mucopolissacarídeos e água, sem a presença de cacifo, podendo ser leve ou progredir até uma condição de risco à vida com angioedema).
O hipotireoidismo pode ser primário ou secundário. O hipotireoidismo primário é resultado de destruição ou disfunção da tireoide. A causa mais comum desse tipo de hipotireoidismo é a tireoidite de Hashimoto, um distúrbio autoimune caracterizado por uma inflamação crônica da tireoide que leva a sua destruição total. O hipotireoidismo primário também pode ser ocasionado por inflamação na tireoide (tireoidite), câncer de tireoide, ausência crônica de iodo na dieta, aplicação de radiação na região de cabeça e pescoço e por distúrbios hereditários que causam alteração das enzimas nas células da tireoide, não permitindo que a glândula produza ou secrete quantidade suficiente de hormônios tireoidianos. O hipotireoidismo secundário é decorrente de um comprometimento da função hipofisária, que leva a uma falha na secreção do TSH, responsável por estimular a tireoide a produzir hormônios tireoidianos. Pode ser ocasionado por tumores hipofisários, lesões na hipófise por traumas ou cirurgia, radioterapia craniana ou defeitos congênitos. Os sintomas são semelhantes aos observados no hipotireoidismo primário. O tratamento para o hipotireoidismo é baseado na reposição de hormônio tireoidiano.
O hipertireoidismo é a hiperatividade da glândula tireoide, resultando em concentrações elevadas de hormônios tireoidianos no sangue e, consequentemente, em alterações no metabolismo, no sistema nervoso e no coração. O hipertireoidismo aumenta o consumo de oxigênio e a produção metabólica de calor, causando sudorese excessiva e intolerância ao calor. O catabolismo das proteínas está aumentado no hipertireoidismo, causando fraqueza muscular e, ocasionalmente, perda de peso. Também são sintomas do hipertireoidismo: irritabilidade, ansiedade, insônia, taquicardia e aumento da pressão arterial, arritmia, alterações na menstruação, exoftalmia e diarreia frequente. A causa mais comum do hipertireoidismo é a doença de Graves, um distúrbio autoimune no qual os anticorpos produzidos pelo próprio organismo estimulam a produção e secreção excessiva de hormônios tireoidianos pela glândula tireoide, resultando na formação do bócio e os outros sintomas característicos da produção excessiva desses hormônios. O hipertireoidismo também pode ser ocasionado por tumores na tireoide ou por hipófise hiperativa (produção de TSH em excesso, levando ao aumento da produção e secreção de hormônios tireoidianos). O tratamento consiste no uso de medicamentos para bloquear a produção dos hormônios tireoidianos, iodo radioativo para promover a destruição total ou parcial da tireoide e, se necessário, remoção cirúrgica total ou parcial da glândula.
Agora, que você conheceu a estrutura da glândula tireoide, seus hormônios produzidos e como eles atuam regulando diferentes funções no organismo, você é capaz de compreender a importância do conhecimento desses temas para uma boa atuação profissional.
Vamos Exercitar?
Agora que você conheceu a estrutura da glândula tireoide, seus hormônios produzidos e como eles atuam regulando diferentes funções no organismo, vamos retomar a situação-problema desta aula. A partir de agora, vamos considerar o caso de Carolina, 35 anos. Ela sempre foi ativa e cheia de energia. Mas, nos últimos meses, tem sentido uma constante sensação de cansaço e fadiga, mesmo depois de uma noite de sono aparentemente boa, o que vem interferindo em sua rotina familiar. Além disso, Carolina percebeu que ganhou peso inexplicavelmente, apesar de não ter mudado sua dieta ou rotina de exercícios, também notou que sua pele está mais seca do que o normal, principalmente nas mãos e nos pés, causando desconforto e coceira. Ela também tem percebido um leve inchaço no pescoço. Preocupada com esses sintomas, Carolina decide procurar ajuda médica e após uma avaliação clínica detalhada e realização de exames laboratoriais, ela é diagnosticada com hipertireoidismo. Seu médico comenta que todos os sintomas que ela apresenta são consequência de uma alteração na glândula tireoide e que, como não tem cura, ela precisará fazer reposição hormonal com levotiroxina por toda vida. Carolina ainda atordoada com a informação e sem entender direito o que realmente tem, pergunta ao médico: “o que é o hipotireoidismo? O que pode causar essa doença? Por que eu preciso fazer reposição hormonal? Tem alguma outra coisa, além da medicação, que posso fazer para auxiliar no tratamento do hipotireoidismo?”. Supondo que você seja o médico, agora, você já é capaz de responder as dúvidas de Carolina. Vamos lá?!
Primeiramente, é importante lembrar que o hipotireoidismo ocorre quando a glândula tireoide não produz hormônios tireoidianos em quantidade suficiente para atender às necessidades do seu corpo. Isso pode acontecer devido a várias causas, incluindo: 1) doença autoimune (como na tireoidite de Hashimoto), na qual o próprio sistema imune do indivíduo destrói as células da tireoide, promovendo uma inflamação da glândula e consequente redução na produção de hormônios tireoidianos; 2) deficiência de iodo na dieta, que torna a tireoide incapaz de produzir os hormônios tireoidianos, uma vez que o iodo é essencial para a síntese desses hormônios; 3) remoção cirúrgica total ou parcial da glândula; 4) exposição à radiação na região de pescoço, como em tratamentos para câncer na região de cabeça e pescoço; e 5) uso de certos medicamentos, como o lítio e interferon, que podem interferir na função tireoidiana e levar ao hipotireoidismo. O tratamento do hipotireoidismo consiste em reposição hormonal com levotiroxina, uma forma sintética do hormônio tireoidiano T4. Essa reposição é necessária porque os hormônios tireoidianos são essenciais para o funcionamento adequado do organismo, pois desempenham um papel fundamental na regulação do metabolismo, energia, temperatura corporal, função cardíaca, digestão e muitos outros processos. A reposição com levotiroxina repõe a quantidade necessária de hormônio tireoidiano para o corpo, corrigindo os sintomas do hipotireoidismo e mantendo o equilíbrio hormonal adequado. Além do tratamento medicamentoso, algumas medidas podem ser tomadas para auxiliar no tratamento do hipotireoidismo, como: 1) manter uma dieta equilibrada e rica em nutrientes, incluindo o iodo; 2) praticar exercícios regularmente para manutenção do metabolismo e, com isso, melhorar os sintomas do hipotireoidismo; 3) evitar estresse, pois este afeta a função da tireoide; e 4) evitar hábitos como tabagismo e consumo excessivo de álcool, que pioram os sintomas do hipotireoidismo.
Saiba Mais
Anatomia e histologia da tireoide
O estudo da tireoide é fundamental para compreender a estrutura e a função dessa glândula endócrina. Conhecer a histologia dessa glândula é crucial para o diagnóstico e tratamento de distúrbios tireoidianos, além de ser essencial para o entendimento das bases fisiológicas e patológicas que impactam a saúde do paciente.
Para saber mais sobre a histologia da glândula tireoide, leia o capítulo indicado a seguir:
- KIMURA, E. T. Glândulas endócrinas. In: JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023. cap. 20, p. 438-442.
Hormônios da tireoide: síntese, liberação e efeitos corporais
Os hormônios da tireoide, triiodotironina (T3) e tiroxina (T4), são produzidos pela glândula tireoide e desempenham papéis essenciais no metabolismo, crescimento e desenvolvimento do corpo. Sua síntese requer iodeto e tirosina, sendo estimulada pelo hormônio estimulante da tireoide (TSH) da glândula pituitária. Uma vez liberados na corrente sanguínea, os hormônios da tireoide afetam praticamente todos os tecidos do corpo, regulando o metabolismo basal, a temperatura corporal, a função cardíaca, o desenvolvimento cerebral, a função gastrointestinal e muito mais. O equilíbrio adequado dos hormônios tireoidianos é crucial para a saúde e o bem-estar geral do ser humano.
Para explorar mais sobre a síntese dos hormônios tireoidianos e suas funções fisiológicas, leia o capítulo indicado a seguir:
- MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021. cap. 4, p. 77-89.
Patologias associadas à glândula tireoide
As patologias associadas à glândula tireoide podem afetar significativamente o metabolismo, crescimento, desenvolvimento e a saúde geral do indivíduo. O reconhecimento precoce, diagnóstico preciso e tratamento adequado dessas patologias são essenciais para garantir o bem-estar e a qualidade de vida dos pacientes, por isso é importante para os futuros profissionais da área da saúde conhecer as principais patologias associadas a essa glândula endócrina.
Para saber mais sobre as patologias associadas à glândula tireoide, leia o capítulo indicado a seguir:
- MAITRA, A. Sistema endócrino. In: KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10 ed. Rio de Janeiro: Guanabara Koogan, 2023. cap. 24, p. 1120-1127.
Referências Bibliográficas
JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023.
KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10. ed. Rio de Janeiro: Guanabara Koogan, 2023.
MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021.
SILVERTHORN, D. U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Aula 2
Glândulas Paratireoides e Pineal
Glândulas paratireoides e pineal
Olá, estudante! Nesta videoaula, você continuará a conhecer o sistema endócrino. Você irá explorar as principais características das glândulas paratireoides e pineal. Você será capaz de compreender como ocorre a produção e liberação do paratormônio pelas glândulas paratireoides e seus efeitos fisiológicos no organismo. Além disso, você irá explorar a anatomia da glândula pineal e entender como ela regula a produção e liberação da melatonina, bem como seu papel na regulação do ciclo sono-vigília. Prepare-se para uma jornada de conhecimento enriquecedora e relevante para sua prática profissional! Vamos lá!
Ponto de Partida
Nesta aula, você, estudante, irá continuar o estudo do sistema endócrino. Você conhecerá as principais características das glândulas paratireoides e pineal, seus hormônios produzidos e seus efeitos fisiológicos, bem como a farmacoterapia com a melatonina, explorando suas aplicações clínicas e considerações terapêuticas. Você será capaz de compreender como esses temas o tornarão preparado para desafios do cotidiano profissional, lidando com situações clínicas complexas de maneira segura e competente. Portanto, aproveite esta oportunidade de aprendizado e esteja preparado para aplicar os conceitos aprendidos no seu cotidiano profissional. Vamos lá?!
A partir de agora, você irá acompanhar o caso de Tiago, um estudante de graduação na área da saúde, que iniciou seu estágio junto à equipe do Programa de Atenção Integral à Saúde de sua universidade. O Programa, realizado em parceria com a Prefeitura, tem como objetivo desenvolver, junto à comunidade, ações de diagnóstico, prevenção, tratamento e reabilitação de doenças, bem como acompanhamento psicossocial. Para tal, o Programa conta com uma equipe multidisciplinar formada por nutricionistas, médicos, enfermeiros, psicólogos, fisioterapeutas, farmacêuticos e biomédicos. Nesse momento, Tiago está acompanhando as discussões de casos clínicos de alguns idosos participantes do Programa. E, durante essa reunião, realizada pela equipe do Programa, foi discutido o caso clínico da paciente M.S.B, 61 anos, que vem sendo acompanhada pela equipe há cerca de dois anos. A paciente procurou o ambulatório da Universidade queixando-se de dores ósseas generalizadas, lombalgia, astenia e palpitações. Apresentava história pregressa de fratura do quadril e osso da mão. Os exames laboratoriais revelaram hipercalcemia, hipofosfatemia, aumento do paratormônio intacto, aumento de fosfatase alcalina óssea e osteocalcina, além do aumento da excreção urinária de cálcio. A densitometria óssea indicou a presença de osteoporose avançada na coluna lombar e colo do fêmur esquerdo. A ultrassonografia do pescoço revelou a presença de uma massa abaixo do lobo esquerdo da tireoide. Foi realizada a remoção cirúrgica dessa massa e, por meio de exame anatomopatológico, foi observado um quadro histológico compatível com adenoma da paratireoide. Frente a todos esses achados, a paciente acabou sendo diagnosticada com hiperparatireoidismo primário. Para aproveitar a presença de vários estagiários junto à equipe, o supervisor do Programa aproveitou para instigar Tiago e seus colegas a relembrar alguns conceitos importantes a respeito das características anatômicas e funcionais das glândulas paratireoides. Ele fez os seguintes questionamentos a eles: “vocês saberiam explicar qual a relação entre os sintomas apresentados pela paciente e as glândulas paratireoides? Qual é a importância dessas glândulas para o funcionamento do nosso organismo?”
Como você, no lugar do Tiago, responderia a todos esses questionamentos?
Vamos Começar!
O sistema endócrino compreende diferentes glândulas que atuam por meio de hormônios secretados no meio interno para regular diversas funções celulares e orgânicas, atuando juntamente com o sistema nervoso na manutenção da homeostasia. Fazendo parte do sistema endócrino, encontramos as glândulas paratireoides e pineal.
Glândulas paratireoides
As glândulas paratireoides são quatro glândulas localizadas na face posterior da glândula tireoide, geralmente duas em cada lobo. Nas paratireoides, as células principais são responsáveis pela produção do paratormônio (PTH), um hormônio envolvido na remodelação óssea, na regulação das concentrações de cálcio e fosfato no sangue e, ainda, na ativação da vitamina D.
A liberação do PTH é regulada por alterações das concentrações de cálcio no plasma, sendo inibida quando essas concentrações estão altas e estimulada quando se encontram baixas. Essas alterações são detectadas por receptores sensíveis ao cálcio presentes nas membranas das células principais. Assim, uma redução nas concentrações plasmáticas de cálcio resulta em aumento da liberação de PTH pelas células principais enquanto o aumento das concentrações de cálcio leva a uma redução da liberação desse hormônio. A liberação do PTH também pode ser modulada por mudanças nas concentrações plasmáticas de fosfato e de magnésio, sendo estimulada por um aumento nos níveis circulantes de fosfato e inibida pela diminuição das concentrações plasmáticas de magnésio.
O PTH atua diretamente sobre os ossos e rins e, indiretamente, sobre o trato gastrointestinal, promovendo aumento das concentrações de cálcio no sangue. Esse aumento se deve a ações do hormônio que resultam em mobilização de cálcio nos ossos (aumenta reabsorção óssea pelos osteoclastos), aumento da reabsorção de cálcio pelos túbulos renais. Nos rins, o PTH também aumenta a excreção de fosfato, reduzindo sua reabsorção. Esses efeitos opostos do PTH sobre o cálcio e o fosfato são necessários para manter suas concentrações abaixo do considerado crítico. Caso haja excedente nas concentrações, cristais de fosfato de cálcio se formam e se precipitam fora da solução. As elevadas concentrações de fosfato de cálcio na urina são uma das causas da formação de cálculos renais. Além disso, por influência do calcitriol, o PTH aumenta a absorção desse íon pelo trato gastrointestinal. Ainda, nos rins, o PTH diminui a reabsorção de fosfato, aumentando sua excreção urinária.
O calcitriol, também conhecido como 1,25-di-hidroxicolecal-ciferol ou vitamina D3, é formado a partir da vitamina D obtida na dieta ou que foi sintetizada na pele, por ação da luz solar, a partir de precursores do colesterol. A vitamina D precisa ser modificada, primeiramente no fígado e depois nos rins, para que o calcitriol seja formado. Nos rins, a formação do calcitriol é regulada pelo PTH. Dessa forma, quando as concentrações plasmáticas de cálcio diminuem, essa redução estimula a secreção de PTH pelas paratireoides que, por sua vez, estimula a síntese de calcitriol, forma ativa da vitamina D. O calcitriol sintetizado é liberado na circulação sanguínea, podendo exercer suas funções biológicas, como aumentar a absorção de cálcio no intestino delgado, além de facilitar a reabsorção renal desse íon e também sua mobilização para fora do osso.
A deficiência de vitamina D pode acarretar várias alterações ou doenças, como o raquitismo e a osteomalácia. Ambas são doenças metabólicas que se caracterizam pela deficiência na mineralização da matriz óssea. O raquitismo afeta o esqueleto na fase de crescimento, portanto reduz a mineralização da matriz da placa epifisária, enquanto a osteomalácia ocorre no adulto, após o fechamento dessas placas. Assim, o que se observa no raquitismo é a presença de deformidades ósseas, fraqueza e deficiência de crescimento. Já na osteomalácia, os defeitos ósseos podem não ser tão evidentes, embora a diminuição da massa óssea esteja presente. Essas doenças podem ser causadas por deficiências nutricionais, distúrbios metabólicos ou por defeitos renais e intestinais. Porém, independentemente da origem, essas doenças são ocasionadas por um suprimento inadequado de cálcio e fosfato, necessários para que ocorra a mineralização dos ossos do esqueleto. A redução de vitamina D ativa promove uma diminuição da absorção intestinal e da mobilização óssea de cálcio, resultando em hipocalcemia. Esta estimula a síntese e liberação de PTH, o qual estimula a mobilização de cálcio do esqueleto, normalizando as concentrações plasmáticas desse íon. Além disso, o PTH promove redução na reabsorção de cálcio, podendo levar a um quadro de hipofosfatemia, que diminui a mineralização óssea. A prevalência de hipovitaminose D vem crescendo mundialmente, em especial na população idosa, como resultado de uma ingestão diminuída da vitamina D na dieta ou mesmo por falta de luz solar, já que esta é necessária para a conversão do precursor inativo na pele à vitamina D ativa.
Outra disfunção que está associada às paratireoides é o hiperparatireoidismo, caracterizado pela hiperatividade dessas glândulas, resultando em aumento das concentrações de PTH no sangue e, consequentemente, aumento das concentrações de cálcio no sangue (hipercalcemia). O hiperparatireoidismo é classificado em tipos primário, secundário e terciário. O hiperparatireoidismo primário resulta de um excesso de secreção de PTH devido a um distúrbio de uma ou mais glândulas paratireoides. Geralmente é ocasionado por um adenoma de paratireoides (tumor benigno). Contudo, também podem ser causas do hiperparatireoidismo primário a hiperplasia (aumento) das paratireoides e câncer de paratireoide, que normalmente envolve apenas uma das glândulas paratireoides. O hiperparatireoidismo primário geralmente é assintomático. Os sintomas, quando ocorrem, são em decorrência da presença de hipercalcemia e hipofosfatemia (concentrações baixas de fosfato no sangue). Assim, podem ser observados sinais e sintomas como: excesso de reabsorção óssea, com transferência do cálcio do tecido ósseo para o sangue, podendo levar à osteoporose; alterações do sistema nervoso central, como falta de concentração, perda de memória, letargia, crises convulsivas e depressão; anormalidades neuromusculares, com fraqueza e fadiga; manifestações cardíacas (calcificações das valvas aórtica e mitral); distúrbios gastrointestinais (constipação intestinal, náuseas, cálculos biliares); e manifestações renais (cálculos renais). O hiperparatireoidismo secundário é causado por qualquer distúrbio não originado nas paratireoides que levem a um quadro de hipocalcemia crônica. Essa condição acarreta uma hiperatividade compensatória das glândulas paratireoides, levando a uma liberação excessiva e crônica de PTH. A causa mais comum do hiperparatireoidismo secundário é a doença renal crônica avançada, que parece estar associada com uma excreção diminuída de fosfato pelos rins, resultando em hiperfosfatemia. As concentrações elevadas de fosfato no sangue reduzem as concentrações de cálcio no sangue, sendo um estímulo para o aumento da atividade das glândulas paratireoides. A doença renal crônica também promove uma redução da produção da forma ativa da vitamina D nos rins, levando à hipocalcemia e, consequentemente, estimulação crônica das paratireoides. O hiperparatireoidismo terciário ocorre quando a atividade das glândulas paratireoides se torna autônoma e excessiva. Desse modo, o PTH é secretado independentemente das concentrações de cálcio no sangue. Geralmente ocorre em indivíduos com hiperparatireoidismo secundário de longa duração ou com doença renal crônica por muitos anos.
O hipoparatireoidismo é caracterizado por uma deficiência do PTH. Esse distúrbio é menos comum que o hiperparatireoidismo e pode ser ocasionado por doença autoimune, dano iatrogênico ou remoção das glândulas paratireoides durante tireoidectomia ou paratireoidectomia. Como nessa condição o indivíduo apresenta hipocalcemia, os sintomas são decorrentes dessa diminuição de cálcio no sangue e incluem: parestesia das mãos ou em torno da boca, câimbras musculares e, em casos mais graves, tetania. O tratamento se baseia em suplementação de cálcio e vitamina D.
Siga em Frente...
Glândula pineal
A glândula pineal é uma glândula endócrina, localizada no diencéfalo, mais precisamente no epitálamo, responsável pela produção e secreção de melatonina, um hormônio amínico derivado da serotonina. A síntese e a secreção de melatonina são influenciadas pelo ciclo de iluminação do ambiente, ou seja, pelos períodos de claro e escuro que caracterizam o dia e a noite, sendo inibidas pela presença de luz e estimuladas por sua ausência. Como consequência do ritmo claro/escuro, a produção e secreção desse hormônio também apresentam um padrão rítmico, sendo maior a noite (período escuro) e menor durante o dia (período claro). Além disso, a duração do período de escuro também influencia diretamente a secreção desse hormônio, variando conforme a ocorrência de noites mais longas ou mais curtas, de acordo com as diferentes estações do ano.
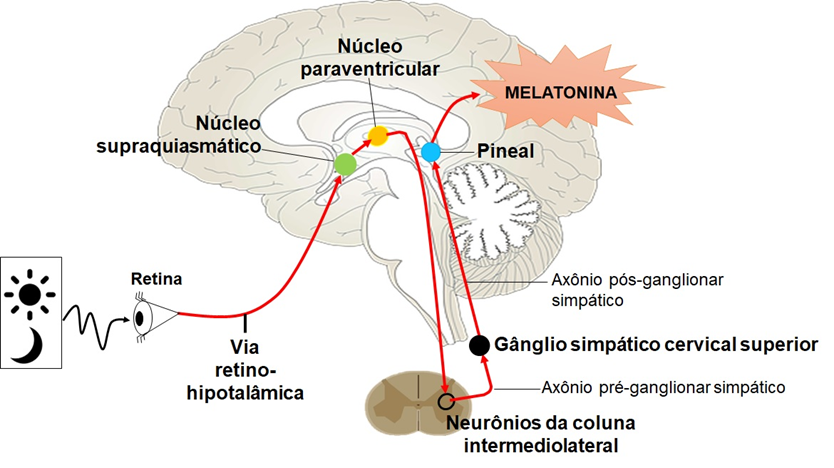
A produção diária ou circadiana de melatonina depende da ativação de vias neurais que começam na retina e se projetam, por meio da via retino-hipotalâmica, para o núcleo supraquiasmático, localizado no hipotálamo. Este envia conexões para o núcleo paraventricular do hipotálamo que, por sua vez, se projeta direta e indiretamente para neurônios simpáticos pré-ganglionares cujos corpos celulares encontram-se na coluna intermediolateral da medula espinal torácica e, desse local, se projetam para gânglios cervicais superiores, fazendo sinapse com neurônios simpáticos pós-ganglionares. Por fim, os axônios dos neurônios simpáticos pós-ganglionares se projetam para a glândula pineal, modulando a atividade dos pinealócitos, células responsáveis pela síntese e liberação de melatonina.
A melatonina, por seu caráter rítmico de secreção, parece atuar como um mediador entre os eventos ambientais cíclicos e as atividades fisiológicas do organismo que são cruciais para a sobrevivência do indivíduo. Assim, são atribuídas à melatonina ações como regulação endócrina, metabólica e reprodutiva, bem como regulação do ciclo sono-vigília, sistema imunológico, entre outras. Por seus efeitos fisiológicos, a melatonina vem sendo utilizada no tratamento de alguns tipos de distúrbios do sono como na insônia por atraso das fases do sono, para indução do sono em casos de latência prolongada para o sono, assim como para regularizar o sono de trabalhadores noturnos que necessitam dormir durante o dia ou para corrigir distúrbios causados pelo jet lag. Também tem sido empregada como tratamento coadjuvante em doenças neurológicas degenerativas que acarretam distúrbios do sono e dos ritmos biológicos circadianos, por promover a regularização do ciclo sono-vigília. Além disso, a melatonina tem sido empregada no tratamento de distúrbios depressivos, de doenças metabólicas, de certos tipos de enxaqueca e como coadjuvante antitumoral e/ou antimetastático.
Agora que você conheceu a estrutura das glândulas paratireoides e pineal, seus hormônios produzidos e como eles atuam regulando diferentes funções no organismo, você é capaz de compreender a importância do conhecimento desses temas para uma boa atuação profissional.
Vamos Exercitar?
Agora que você conheceu a estrutura das glândulas paratireoides e pineal, seus hormônios produzidos e como eles atuam regulando diferentes funções no organismo, vamos retomar a situação-problema. A partir de agora, vamos considerar o caso do Tiago, um estudante da área da saúde que faz um estágio em um Programa de Atenção Integral à Saúde de sua Universidade. Ele está acompanhando as discussões de casos clínicos de alguns idosos participantes do Programa. E, durante essa reunião, foi discutido o caso clínico da paciente M.S.B, 61 anos, que vem sendo acompanhada pela equipe há cerca de dois anos. A paciente procurou o ambulatório da Universidade queixando-se de dores ósseas generalizadas, lombalgia, astenia e palpitações. Apresentava história pregressa de fratura do quadril e osso da mão. Os exames laboratoriais revelaram hipercalcemia, hipofosfatemia, aumento do paratormônio intacto, aumento de fosfatase alcalina óssea e osteocalcina, além do aumento da excreção urinária de cálcio. A densitometria óssea indicou a presença de osteoporose avançada na coluna lombar e colo do fêmur esquerdo. A ultrassonografia do pescoço revelou a presença de uma massa abaixo do lobo esquerdo da tireoide. Foi realizada a remoção cirúrgica dessa massa e, por meio de exame anatomopatológico, foi observado um quadro histológico compatível com adenoma da paratireoide. Frente a todos esses achados, a paciente foi diagnosticada com hiperparatireoidismo primário. Durante as discussões, o supervisor do Programa aproveitou para instigar Tiago e seus colegas a relembrar alguns conceitos importantes a respeito das glândulas paratireoides, fazendo os seguintes questionamentos: “vocês saberiam explicar qual a relação entre os sintomas apresentados pela paciente e as glândulas paratireoides? Qual é a importância dessas glândulas para o funcionamento do nosso organismo?”
Agora você já é capaz de responder aos questionamentos do supervisor. Vamos lá?!
Primeiramente, é importante lembrar que o hiperparatireoidismo primário é ocasionado pela hiperatividade das glândulas paratireoides, que resulta em aumento da liberação de paratormônio (PTH) no sangue. O aumento do PTH leva à mobilização excessiva de cálcio dos ossos para o sangue e à diminuição da reabsorção de fosfato pelos rins, resultando em hipercalcemia (aumento dos níveis de cálcio) e hipofosfatemia (diminuição dos níveis de fosfato) no sangue. Isso explica as dores ósseas generalizadas e a história pregressa de fraturas ósseas da paciente. O aumento do PTH estimula a atividade osteoclástica, resultando na liberação de cálcio dos ossos para o sangue. O PTH também aumenta a reabsorção de cálcio pelos rins e a conversão de vitamina D em sua forma ativa, promovendo a absorção intestinal de cálcio. Esses mecanismos também contribuem para a hipercalcemia observada na paciente. A fosfatase alcalina óssea e a osteocalcina são marcadores de atividade osteoblástica. No hiperparatireoidismo, o aumento do PTH também estimula a atividade osteoblástica, levando ao aumento da fosfatase alcalina óssea e osteocalcina. O aumento do PTH aumenta a reabsorção de cálcio nos túbulos renais, levando à excreção urinária aumentada de cálcio. Isso pode resultar em nefrolitíase (formação de cálculos renais) e explicar as queixas de lombalgia e a astenia da paciente. É importante lembrar que as glândulas paratireoides são fundamentais para manter a homeostase do cálcio e do fosfato no organismo, que são minerais essenciais para várias funções fisiológicas, incluindo: contratilidade muscular e função neuromuscular, coagulação sanguínea, função cardíaca (incluindo a condução elétrica do coração), função do sistema nervoso central (incluindo neurotransmissão), ativação de enzimas intracelulares; formação e mineralização óssea. Portanto, o funcionamento adequado das glândulas paratireoides é vital para garantir a integridade e o funcionamento adequado de muitos sistemas do organismo. O desequilíbrio na função dessas glândulas, como no caso do hiperparatireoidismo primário da paciente M.S.B, pode resultar em uma série de sintomas e complicações relacionadas ao metabolismo do cálcio e fosfato.
Saiba Mais
Síntese e liberação do hormônio da paratireoide. Efeitos fisiológicos do PTH.
As glândulas paratireoides, geralmente quatro pequenas estruturas localizadas na parte posterior da tireoide, são responsáveis pela produção do hormônio paratormônio (PTH). Este hormônio desempenha um papel fundamental no controle dos níveis de cálcio no sangue, promovendo sua liberação dos ossos, reabsorção nos rins e ativação da vitamina D para aumentar a absorção intestinal de cálcio. A regulação precisa do PTH é essencial para a saúde óssea, a função muscular, a condução nervosa e a coagulação sanguínea, destacando sua grande importância para o equilíbrio mineral e a homeostase no organismo humano.
Para saber mais sobre as glândulas paratireoides, leia o capítulo indicado a seguir:
- MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021. cap. 5, p. 101-117.
Anatomia da glândula pineal e a liberação de melatonina
A glândula pineal, localizada no cérebro, desempenha um papel vital na regulação dos ritmos circadianos e na produção de melatonina. Esta pequena glândula é sensível à luz, com sua produção de melatonina sendo inibida durante o dia e aumentada à noite, influenciando o ciclo sono-vigília. A melatonina não apenas induz o sono, mas também regula o sistema imunológico, protege contra o estresse oxidativo e desempenha um papel crucial na saúde mental. Sua liberação sincronizada com o ciclo natural de luz e escuridão é essencial para o bem-estar e a regulação de diversos processos fisiológicos no ser humano.
Para saber mais sobre a glândula pineal e sua importância para o organismo humano, acesse a seguinte obra:
- Glândula pineal. Kenhub.
Farmacoterapia com melatonina
A melatonina é um hormônio produzido pela glândula pineal, cuja principal função é regular o ciclo sono-vigília, promovendo o sono e sincronizando os ritmos circadianos. Além disso, a melatonina desempenha um papel importante na regulação do sistema imunológico, no combate ao estresse oxidativo e na proteção do organismo contra danos celulares. Como terapia medicamentosa, a melatonina é frequentemente utilizada para tratar distúrbios do sono, como insônia e o jet lag, e mostra potencial em outras condições, como distúrbios do humor, doenças neurodegenerativas e como adjuvante no tratamento do câncer. Seu uso terapêutico tem sido associado a melhorias significativas na qualidade do sono e no bem-estar geral dos pacientes.
Para explorar mais a respeito dos riscos e benefícios provenientes do uso da melatonina como terapia medicamentosa, leia o artigo disponibilizado no link a seguir:
- SILVA, A. R.; SILVA, D. M.; GOMES, I. C.; GOMES, A. T. A. A automedicação e o uso da melatonina: revisão integrativa da literatura. Brazilian Journal of Health Review, v. 4, n. 5, p. 21460–21483, 2021. DOI: 10.34119/bjhrv4n5-235.
Referências Bibliográficas
CURI, R.; PROCOPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10. ed. Rio de Janeiro: Guanabara Koogan, 2023.
MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Aula 3
Glândulas Adrenais
Glândulas adrenais
Olá, estudante! Nesta videoaula, você continuará a conhecer o sistema endócrino. Você irá explorar anatomia e histologia das adrenais, compreendendo a estrutura microscópica e macroscópica dessas glândulas. Você será capaz de compreender quais hormônios elas produzem, quais seus efeitos biológicos e quais patologias podem estar associadas a elas. Prepare-se para uma jornada de conhecimento enriquecedora e diretamente aplicável à sua prática profissional! Vamos lá!
Ponto de Partida
Nesta aula, você, estudante, continuará a conhecer o sistema endócrino, mais especificamente as glândulas adrenais, também conhecidas como suprarrenais. Primeiramente, você conhecerá quais são suas principais características anatômicas e histológicas, compreendendo sua estrutura e organização celular. Em seguida, você será capaz de compreender quais são os hormônios produzidos por essas glândulas e suas ações no organismo humano. Por fim, você irá explorar as principais patologias associadas às adrenais, que proporcionará uma visão abrangente e prática para desafios enfrentados na sua rotina profissional. Prepare-se para mergulhar nesse universo fascinante de conhecimento! Vamos lá!
A partir de agora, você irá acompanhar o Pedro, um aluno de graduação na área da saúde. Pedro é estagiário junto à equipe multidisciplinar de sua Instituição. Nesse momento, ele está acompanhando a discussão do caso clínico da paciente S.T.R., 34 anos, atendida no Ambulatório da Universidade. No primeiro atendimento, a paciente queixou-se de “escurecimento da pele”, que havia se iniciado há cerca de dois anos. Além disso, há aproximadamente seis meses, a paciente vem apresentando náuseas, fadiga, mialgia, perda de peso e episódios de hipotensão postural. A paciente apresentava-se lúcida e em bom estado geral, apesar da perda de peso. Os exames laboratoriais mostraram níveis baixos de cortisol sérico e ACTH muito elevado. Não havia histórico de tuberculose, trauma, cirurgias e outras comorbidades. Adicionalmente, a paciente negou tabagismo, etilismo, uso de drogas ou de qualquer medicação. Frente aos dados clínicos apresentados e resultados dos exames laboratoriais, ela foi diagnosticada com Doença de Addison. Como rotina das discussões entre a equipe multidisciplinar e seus estagiários, o caso clínico apresentado foi utilizado para que estes fossem instigados a relembrar conceitos anatômicos e funcionais importantes sobre as glândulas adrenais e, desse modo, relacioná-los à sua realidade profissional. Para tal, o supervisor da equipe levantou os seguintes questionamentos a Pedro e seus colegas: “vocês saberiam explicar qual a relação entre os sintomas apresentados pela paciente e as glândulas adrenais? Qual é a importância dessas glândulas para o funcionamento do nosso organismo?”
Como você, no lugar Pedro, responderia a todos esses questionamentos?
Vamos Começar!
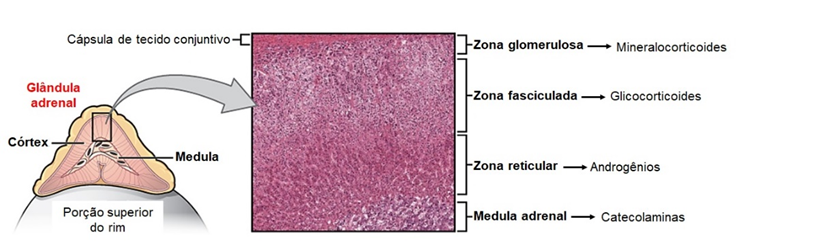
As glândulas adrenais estão localizadas no espaço retroperitoneal logo acima dos rins, sendo uma de cada lado. Essas glândulas são formadas por duas regiões distintas: o córtex e a medula. O córtex é a porção externa da adrenal, correspondendo a maior parte dessa glândula, com origem a partir do mesoderma, e responsável pela produção de hormônios esteroides (mineralocorticoides, glicocorticoides e androgênios). Já a medula, porção mais interna da glândula, cuja origem deriva de células neuroectodérmicas dos gânglios simpáticos, é responsável pela produção de catecolaminas (norepinefrina e epinefrina).
Córtex
O córtex pode ser subdividido em três zonas com características morfofuncionais distintas: 1) zona glomerulosa, região mais externa, correspondendo a 15% do córtex, responsável pela produção de mineralocorticoides, como a aldosterona; 2) zona fasciculada, região intermediária, correspondendo a cerca de 85% do córtex, responsável pela produção de glicocorticoides (cortisol); e 3) zona reticular, região mais interna do córtex, responsável pela produção de esteroides sexuais, principalmente androgênios.
Os hormônios esteroides produzidos pelo córtex adrenal são sintetizados a partir do colesterol, principalmente oriundo das lipoproteínas circulantes. Cada zona do córtex apresenta diferentes enzimas específicas que promovem a hidroxilação dos esteroides, determinando o perfil dos produtos (hormônios) que serão secretados por cada uma das regiões. Dessa forma, o colesterol é metabolizado por diferentes enzimas específicas presentes em cada uma das zonas, chamadas enzimas esteroidogênicas, resultando na formação de cortisol, aldosterona ou de androgênios. A síntese dos hormônios esteroides (esteroidogênese) se inicia com a conversão do colesterol em pregnenolona. Nessa primeira etapa, que é limitante para todos os esteroides e ocorre na mitocôndria, é necessário que ocorra primeiramente a liberação do colesterol, por ação da enzima colesterol esterase, e depois pela transferência dessa molécula da membrana externa para a membrana interna mitocondrial, pela ação da proteína reguladora aguda da esteroidogênese (StAR). Em seguida, ocorre a remoção da cadeia lateral da molécula de colesterol pela enzima 20,22-desmolase, também conhecida como P450scc, resultando na pregnenolona. Na síntese da aldosterona, que ocorre nas células da zona glomerulosa, a pregnenolona inicialmente se desloca para o citosol das células, onde é convertida em progesterona, por ação enzimática da 3β-hidroxiesteroide desidrogenase (3β-HSD) e de uma isomerase. Na próxima etapa da síntese de aldosterona, a progesterona sofre uma hidroxilação no carbono 21, reação catalisada pela enzima 21α-hidroxilase, resultando na formação da 11-desoxicorticosterona (DOCA), um mineralocorticoide potente, porém secretado em pequenas quantidades. A maior parte da DOCA formada sofre hidroxilação na mitocôndria, pela enzima 11β-hidroxilase, produzindo corticosterona, que, sob ação da enzima aldosterona sintase, é convertida em aldosterona. A síntese de cortisol segue as primeiras etapas descritas para a aldosterona até a produção de progesterona. A partir dessa etapa, ocorre uma nova hidroxilação na molécula pela ação da enzima 17α-hidroxilase. Essa etapa pode acontecer antes ou após a conversão da pregnenolona em progesterona. Caso aconteça antes, a molécula formada será a 17α-hidroxipregnenolona; se ocorrer após a conversão da pregnenolona em progesterona, o produto será a 17α-hidroxiprogesterona. A 17α-hidroxipregnenolona formada pode ser convertida em 17α-hidroxiprogesterona, em uma sequência de reações que envolvem a enzima 3β-HSD e uma isomerase, constituindo as mesmas enzimas que convertem a pregnenolona em progesterona. A 17α-hidroxiprogesterona é convertida no retículo endoplasmático liso em 11-desoxicortisol pela enzima 21α-hidroxilase. E, finalmente, por ação da 11β-hidroxilase, o 11-desoxicortisol é convertido em cortisol. A síntese de androgênios ocorre na zona reticular das glândulas adrenais a partir da conversão da 17α-hidroxipregnenolona e 17α-hidroxiprogesterona nos androgênios desidroepiandrosterona (DHEA) e androstenediona, respectivamente. Nessa etapa, as reações são catalisadas pela 17,20-desmolase. Como no ser humano a conversão da 17α-hidroxiprogesterona em androstenediona é muito pequena, a síntese desse androgênio depende da conversão de DHEA por ação da 3β-HSD e da isomerase. A maior parte de DHEA sintetizada é sulfatada, formando o sulfato de desidroepiandrosterona (DHEA-S), por ação da DHEA sulfotransferase. A androstenediona que, assim como o DHEA, é um androgênio pouco potente, é convertida em testosterona pela enzima 17-cetoesteroide redutase. É importante lembrar que a adrenal acaba sendo responsável por uma pequena quantidade de testosterona produzida, uma vez que a maior parte de DHEA é sulfatada e que a síntese de androstenediona é dependente da conversão de DHEA. Desse modo, no homem e em condições fisiológicas, a principal fonte de testosterona é testicular, com uma pequena contribuição das adrenais. Já na mulher, bem diferente do observado no homem, a secreção de androgênios pelas adrenais corresponde a mais de 50% das concentrações de androgênios circulantes. Contudo, é importante lembrar que as concentrações plasmáticas de androgênios na mulher são bem menores que as observadas em homens.
A regulação da secreção de cortisol é realizada pelo eixo hipotálamo-hipofisário. Os corticotrofos presentes na adeno-hipófise são responsáveis pela secreção de hormônio adrenocorticotrófico (ACTH) ou corticotrofina, cuja síntese e liberação são dependentes do hormônio liberador de corticotrofina (CRH), um neuropeptídeo secretado por neurônios hipotalâmicos. O ACTH secretado em resposta ao CRH é transportado pela corrente sanguínea até as adrenais, onde estimula as células da zona fasciculada a produzirem e secretarem o cortisol. Por outro lado, o cortisol circulante, por um mecanismo de retroalimentação negativa, inibe a liberação de ACTH pelos corticotrofos na adeno-hipófise e de CRH pelos neurônios hipotalâmicos envolvidos. O ACTH exerce seus efeitos estimulatórios sobre o córtex adrenal de diferentes formas: 1) estimulando a atividade da 20,22-desmolase, enzima responsável pela remoção da cadeia lateral do colesterol, permitindo que haja a conversão a pregnenolona; 2) mediando o transporte do colesterol da membrana externa para a membrana interna da mitocôndria, por aumentar a atividade da StAR; e, 3) estimulando a captação de colesterol para a esteroidogênese. A síntese e secreção da aldosterona são regulados pela angiotensina II, um componente do sistema renina-angiotensina, e pelo potássio e ACTH. A angiotensina II atua nas adrenais aumentando a conversão de colesterol em pregnenolona, uma vez que estimula a atividade da 20,22-desmolase, e estimulando a aldosterona sintase e, consequentemente, a conversão de corticosterona em aldosterona. O potássio também estimula a produção de pregnenolona e a conversão da corticosterona em aldosterona. E a regulação da síntese e secreção de androgênios é dependente, principalmente, da ação do ACTH. Os glicocorticoides exercem efeitos sobre o metabolismo intermediário, como: 1) proteólise, principalmente nas fibras musculares; 2) aumento da gliconeogênese e diminuição da captação de glicose; 3) diminuição da sensibilidade à insulina; 4) aumento da lipólise e lipogênese. Além desses efeitos, os glicocorticoides também atuam promovendo resistência ao estresse, ações anti-inflamatórias, depressão das respostas imunológicas, manutenção do volume dos fluidos corporais, remodelamento ósseo e, durante o desenvolvimento fetal, atua no desenvolvimento normal de diferentes órgãos e tecidos corporais. Os mineralocorticoides exercem seus efeitos biológicos promovendo, nos túbulos renais, o aumento da reabsorção de sódio e água, da excreção de potássio e secreção de íons hidrogênio. Dessa forma, a aldosterona atua na regulação do balanço de sódio e potássio e do volume do fluido extracelular. Os androgênios produzidos pelas adrenais são responsáveis pela estimulação do crescimento de pelos axilares e pubianos, em meninos e meninas antes da ativação da esteroidogênese gonadal. Em mulheres adultas, os androgênios adrenais são importantes para o desenvolvimento da libido, além de serem convertidos em estrogênios em outros tecidos corporais. Em mulheres na menopausa, a conversão de androgênios em estrogênios nos tecidos periféricos torna-se uma fonte importante de atividade estrogênica. Em homens adultos, os androgênios exercem efeitos fisiológicos mínimos quando comparados aos efeitos dos androgênios secretados pelos testículos.
Medula adrenal
A medula adrenal, porção mais interna da glândula, representa cerca de 15% desta, sendo formada por células cromafins, responsáveis pela produção e secreção de catecolaminas (epinefrina e norepinefrina). A principal catecolamina produzida é a epinefrina (adrenalina), constituindo aproximadamente 80% do produto de secreção dessa porção da adrenal. Em condições basais, a quantidade de norepinefrina secretada pela suprarrenal é pequena, sendo a maior parte dessa catecolamina oriunda das fibras simpáticas pós-ganglionares que inervam os tecidos. As catecolaminas são derivadas da tirosina obtida na dieta ou formada a partir da fenilalanina e transportada para dentro das células cromafins. A tirosina é inicialmente convertida em di-hidroxifenilalanina (DOPA) por ação da enzima tirosina hidroxilase. Em seguida, a DOPA é transformada em dopamina, pela enzima dopa-descarboxilase. A dopamina, sob a ação da dopamina β-descarboxilase, é hidroxilada a norepinefrina. E, esta, no citosol celular, transforma-se em epinefrina, por ação da enzima feniletanolamina-N-metiltransferase (PNMT). As catecolaminas, após serem sintetizadas, permanecem armazenadas em grânulos nas células cromafins.
A síntese de catecolaminas adrenais é estimulada pelas terminações simpáticas de neurônios pré-ganglionares, cujos corpos celulares se encontram na medula espinal. A acetilcolina liberada por esses neurônios atua sobre receptores nicotínicos presentes nas células cromafins, estimulando a atividade das enzimas tirosina hidroxilase e dopamina β-descarboxilase, bem como a migração dos grânulos secretórios repletos de catecolaminas em direção à periferia e exocitose do conteúdo presentes nos grânulos. A síntese de epinefrina também pode ser estimulada pelo ACTH e pelo cortisol. O ACTH promove aumento da atividade das enzimas tirosina hidroxilase e dopamina β-descarboxilase e consequente aumento da síntese de DOPA e norepinefrina. O cortisol, por sua vez, estimula a PNMT, aumentando a conversão de norepinefrina em epinefrina. Os efeitos fisiológicos das catecolaminas envolvem ações sobre o metabolismo intermediário, sistema cardiovascular e musculatura lisa visceral. A tabela a seguir apresenta as principais ações das catecolaminas nas estruturas corporais.

Siga em Frente...
Alterações na produção dos diferentes hormônios das glândulas adrenais podem resultar na perda da homeostase corporal e consequente aparecimento de patologias. Dentre as principais patologias associadas às glândulas adrenais, temos:
- Síndrome de Cushing: se refere às manifestações ocasionadas pelo aumento excessivo na síntese de glicocorticoides, podendo ser subdividida em três tipos principais: 1) independente de ACTH, geralmente ocasionada por uma neoplasia na adrenal, levando à secreção excessiva de cortisol, mesmo na presença da supressão do ACTH devido ao mecanismo de retroalimentação negativa; 2) dependente de ACTH, ou seja, há produção excessiva de ACTH ocasionada por um tumor nos corticotrofos da adeno-hipófise, nesse caso é denominada doença de Cushing; e 3) dependente de ACTH, porém ocasionada por uma neoplasia não hipofisária, mas que secreta ACTH. Existe ainda a síndrome de Cushing iatrogênica, resultado de terapia farmacológica a longo prazo com glicocorticoides. Na síndrome de Cushing, a secreção aumentada de cortisol leva ao ganho de peso, com distribuição centrípeta de gordura e formação de uma “corcova de búfalo”. Além disso, há deposição de gordura nas bochechas, caracterizando a “face lunar”, perda de massa óssea, atrofia e fraqueza muscular, ocasionadas pela ação proteolítica do cortisol, assim como intolerância à glicose, hiperglicemia e resistência à insulina. Também pode ocorrer hipertensão.
- Doença de Addison: ocasionada pela redução na síntese de glicocorticoides, como resultado da destruição das camadas corticais da glândula adrenal, ocasionada por diferentes causas como processo autoimune e agentes infecciosos.
- Síndrome de Conn: caracterizada pela produção excessiva de aldosterona desencadeada por um tumor na adrenal. Os sintomas mais comuns são hipertensão e hipocalemia.
Agora que você conheceu as principais características estruturais e funcionais das glândulas adrenais, você é capaz de compreender a importância do conhecimento desse tema para uma atuação profissional adequada e segura, visando o bem-estar e a promoção da saúde.
Vamos Exercitar?
Agora que você conheceu e aprendeu a respeito das principais características anatômicas e funcionais das glândulas adrenais, vamos retomar a situação-problema. A partir de agora, vamos considerar que você seja Pedro, um estagiário da área da saúde na Universidade de sua cidade. Nessa etapa do seu estágio, você está acompanhando, junto à equipe multidisciplinar, a discussão do caso de uma paciente que apresentava os seguintes achados clínicos: hiperpigmentação mucocutânea, náuseas, fadiga, mialgia, perda de peso, episódios de hipotensão postural, níveis baixos de cortisol sérico e ACTH muito elevado. E, diante de todos os achados clínicos e laboratoriais, a paciente acabou sendo diagnosticada com Doença de Addison. Aproveitando o quadro clínico apresentado, o supervisor da equipe aproveitou para realizar os seguintes questionamentos a você e seus colegas de estágio: “vocês saberiam explicar qual a relação entre os sintomas apresentados pela paciente e as glândulas adrenais? Qual é a importância dessas glândulas para o funcionamento do nosso organismo?”.
Agora, você já é capaz de responder o seu supervisor. Vamos lá?
Primeiramente, é importante lembrar que as glândulas adrenais podem ser divididas em duas regiões distintas: córtex e medula. O córtex, por sua vez, apresenta três regiões (zona glomerulosa, zona fasciculada e zona reticular). A zona glomerulosa produz mineralocorticoides, a zona fasciculada é responsável pela produção de glicocorticoides e a zona reticular sintetiza androgênios. Os glicocorticoides produzidos no córtex adrenal exercem vários efeitos biológicos no nosso organismo, visto que receptores específicos para eles são encontrados em quase todos os tecidos corporais. Assim, alterações na produção de glicocorticoides (cortisol) afetam a homeostase corporal e, consequentemente, podem acabar acarretando doenças. Um dos distúrbios endócrinos relacionados às alterações no funcionamento das glândulas adrenais é a doença de Addison ou insuficiência adrenocortical primária. Esta é uma doença rara, caracterizada pela incapacidade das glândulas adrenais de produzirem quantidades adequadas de glicocorticoides, como resultado de um defeito presente na própria glândula devido à destruição das suas camadas corticais. A doença de Addison pode apresentar diferentes causas como: hemorragias, neoplasias ou metástases, infecções como a tuberculose, medicamentos, entre outros. Os sintomas mais comuns dessa patologia incluem hipotensão postural, hiponatremia, hiperpigmentação cutânea e mucosa, astenia, perda de peso, fadiga, náuseas e vômitos. Na doença de Addison, observa-se a destruição das camadas corticais das adrenais, o que geralmente acarreta uma deficiência de glicocorticoides e mineralocorticoides. Como o cortisol, por meio de mecanismo de retroalimentação negativa, inibe a síntese e liberação de ACTH, na doença de Addison, a deficiência na produção de cortisol acaba resultando na produção e secreção excessiva de ACTH. De fato, na situação-problema, a paciente apresenta níveis baixos de cortisol sérico e ACTH muito elevado. Uma consequência da produção excessiva de ACTH é a hiperpigmentação observada em mucosas e pele. O ACTH, quando em quantidades excessivas, se liga ao receptor 1 da melanocortina (MC1R) localizados nos melanócitos da pele e mucosas, estimulando a síntese e dispersão da melanina e, dessa forma, ocasionando o escurecimento dessas estruturas. A diminuição de mineralocorticoides leva à redução do volume extracelular, resultando em hipovolemia e, consequentemente, em queda da pressão arterial. Ainda, com a diminuição da produção de cortisol, há uma diminuição da resistência vascular periférica, devido à vasodilatação generalizada, predispondo à ocorrência de hipotensão arterial. A deficiência de cortisol também acarreta anemia, uma vez que o cortisol estimula a produção de eritropoietina, estimulando a produção de glóbulos vermelhos. No Addison, pela diminuição do cortisol, temos a redução da motilidade e secreção do trato gastrointestinal, diminuição da absorção de vitamina B12 e ferro, e diminuição do apetite, fatores predisponentes à perda de peso. O tratamento dessa patologia envolve a administração oral diária de glicocorticoides e mineralocorticoides.
Saiba Mais
Anatomia e histologia das adrenais
As adrenais, ou suprarrenais, são estruturas localizadas acima dos rins, compostas por uma região externa, a córtex adrenal, e uma região interna, a medula adrenal. A córtex adrenal é subdividida em zonas que produzem diferentes tipos de hormônios, como glicocorticoides, mineralocorticoides e androgênios. Já a medula adrenal é responsável pela produção de catecolaminas, como a adrenalina e noradrenalina. Compreender a anatomia e histologia das adrenais permite o diagnóstico preciso e o tratamento eficaz de distúrbios endócrinos relacionados a essas glândulas, garantindo o cuidado adequado aos pacientes.
Para explorar mais sobre a histologia das adrenais e implicações nas suas ações fisiológicas, leia a seguinte obra disponível na Biblioteca Virtual:
- KIMURA, E. T. Glândulas endócrinas. In: JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023. cap. 20, p. 431-436.
Síntese dos hormônios adrenocorticais e da medula adrenal e suas ações
A síntese dos hormônios produzidos pelo córtex adrenal, como os glicocorticoides e os mineralocorticoides, e os produzidos pela medula adrenal, as catecolaminas, é crucial para a regulação do metabolismo, resposta ao estresse, equilíbrio eletrolítico e controle da pressão arterial. Esses hormônios desempenham papéis fundamentais na adaptação do corpo a situações de estresse físico e emocional, na manutenção da homeostase e na resposta imunológica. O conhecimento desses processos é essencial para profissionais de saúde, pois permite a compreensão das bases fisiológicas das doenças endócrinas e a escolha adequada das intervenções terapêuticas.
Para saber mais sobre os hormônios produzidos pelas glândulas adrenais, leia:
- MOLINA, P. E. Fisiologia endócrina. 5 ed. Porto Alegre: AMGH, 2021. cap. 6, p. 134-146.
Patologias e farmacoterapia relacionadas à adrenal
Os distúrbios associados às glândulas adrenais podem ser causados por hiper (produção excessiva de hormônio) ou hipofunção (produção ausente ou deficiente de hormônio) dessas glândulas. Você sabe quais são as principais doenças decorrentes de alterações no funcionamento normal das adrenais? Qual a relação entre os efeitos fisiológicos exercidos pelos diferentes hormônios adrenais com as patologias relacionadas a essa glândula?
Para saber mais sobre esse assunto, leia:
- MAITRA, A. Sistema endócrino. In: KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10. ed. Rio de Janeiro: Guanabara Koogan, 2023. cap. 24, p. 1161-1177.
Referências Bibliográficas
CURI, R.; PROCOPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10. ed. Rio de Janeiro: Guanabara Koogan, 2023.
MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Aula 4
Pâncreas Endócrino
Pâncreas endócrino
Olá, estudante! Nesta videoaula, você continuará a conhecer o sistema endócrino. Você irá explorar anatomia e histologia do pâncreas endócrino, compreendendo a sua estrutura microscópica e macroscópica. Você será capaz de compreender quais hormônios ele produz e quais seus efeitos fisiológicos. Prepare-se para uma jornada de conhecimento enriquecedora e diretamente aplicável à sua prática profissional! Vamos lá!
Ponto de Partida
Nesta aula, você, estudante, continuará a conhecer o sistema endócrino, mais especificamente as glândulas adrenais, também conhecidas como suprarrenais. Primeiramente, você conhecerá quais são suas principais características anatômicas e histológicas, compreendendo sua estrutura e organização celular. Em seguida, você será capaz de compreender quais são os hormônios produzidos por essas glândulas e suas ações no organismo humano. Por fim, você irá explorar as principais patologias associadas às adrenais, que proporcionará uma visão abrangente e prática para desafios enfrentados na sua rotina profissional. Prepare-se para mergulhar nesse universo fascinante de conhecimento! Vamos lá!
A partir de agora, você irá acompanhar o Gabriel, um aluno de graduação na área de saúde que está fazendo um estágio em uma Unidade Básica de Saúde de sua cidade. Nesse momento, Gabriel está acompanhando o caso de Maria, 52 anos, que tem diabetes mellitus tipo 2. Maria é obesa e vem sendo tratada na unidade há dois anos. Ela faz uso de insulina diariamente, além de hipoglicemiantes orais após as refeições. Porém, apesar do tratamento, Maria não tem seguido uma dieta adequada e não pratica exercícios físicos regularmente. Nessa consulta de acompanhamento, Maria demonstrou preocupação com sua saúde após ler notícias na internet sobre os possíveis impactos do diabetes mal controlado. Ela expressou várias dúvidas sobre sua condição e seu tratamento, e pediu alguns esclarecimentos a Gabriel que a acompanhava antes da consulta. Maria gostaria de saber: “por que ela precisava aplicar insulina diariamente? Além da insulina, por que era necessário o hipoglicemiante oral após as refeições? Quais seriam de fato as consequências de não seguir um tratamento adequado para o diabetes? É verdade que ela poderia ficar cega?”. Como você, no lugar de Gabriel, responderia a todos esses questionamentos?
Vamos Começar!
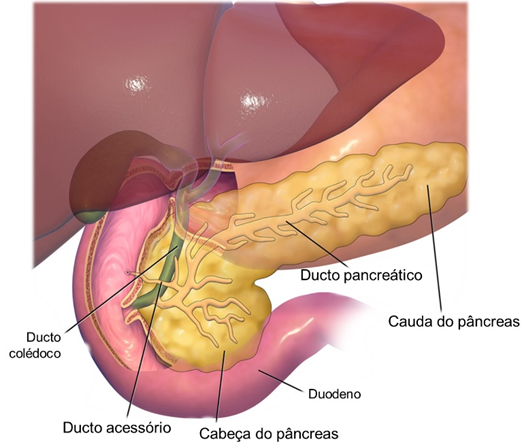
O pâncreas é um órgão achatado que mede cerca de 12,5 a 15 cm de comprimento. Ele está localizado na curvatura do duodeno e consiste em uma cabeça, um corpo e uma cauda. É considerado uma glândula de secreção exócrina e endócrina, que desempenha uma importante função na absorção, na distribuição e no armazenamento de nutrientes. O pâncreas exócrino é constituído pelos ácinos pancreáticos, os quais produzem enzimas que agem no processo de digestão, fluindo para o sistema digestório por uma rede de ductos. Entre os ácinos pancreáticos, há as ilhotas pancreáticas, ou ilhotas de Langerhans, que representam a parte endócrina da glândula, produzindo hormônios, como a insulina, o glucagon, a somatostatina e o polipeptídio pancreático. As ilhotas são mais numerosas na cauda do pâncreas, e seu volume corresponde a cerca de 1% do total da massa pancreática. Cada ilhota pancreática apresenta quatro tipos de células secretoras de hormônio: 1) células alfa, que constituem cerca de 17% das células das ilhotas pancreáticas e são secretoras de glucagon e peptídeos similares ao glucagon (GLP-1 e GLP-2); 2) células beta, que constituem cerca de 70% das células das ilhotas pancreáticas e secretam insulina, peptídeo C, amilina e ácido γ-aminobutírico (GABA); 3) células delta, que constituem cerca de 7% das ilhotas pancreáticas, secretando somatostatina; e 4) células F, que constituem o restante das células das ilhotas pancreáticas e secretam polipeptídio pancreático.
A insulina, secretada pelas células beta pancreáticas, é uma proteína sintetizada como pré-pro-insulina nos ribossomos do retículo endoplasmático rugoso dessas células. Esse pré-pro-hormônio sofre clivagem por enzimas microssomais, dando origem à pro-insulina, que é armazenada no aparelho de Golgi em grânulos. Nesses grânulos, a pro-insulina é hidrolisada, originando a insulina e um peptídeo de conexão, o peptídeo C. A insulina endógena tem uma meia-vida de três a cinco minutos, sendo degradada no fígado, no rim e na placenta. O pâncreas humano secreta, em média, 40 a 50 UI de insulina por dia. A secreção basal desse hormônio ocorre sem estímulos, ou seja, durante o jejum, mas pode sofrer influência de estímulos, que regulam o aumento ou diminuição da sua liberação. A glicose é o estímulo mais potente para as células beta, promovendo aumento da secreção da insulina. Quando ocorre um aumento agudo nas concentrações de glicose no sangue, há como consequência um rápido aumento nas concentrações de insulina, com pico entre três e cinco minutos, e duração de aproximadamente dez minutos. Essa fase da resposta insulínica é denominada de fase precoce ou primeira fase. A segunda fase ocorre caso as concentrações séricas de glicose se mantenham altas. Nesse caso, a secreção de insulina é sustentada, iniciando em 15 a 20 minutos e atingindo seu pico nos próximos 20 a 40 minutos.
Os hormônios entéricos que medeiam a secreção pós-alimentar de insulina são chamados de incretinas, sendo o polipeptídio inibitório gástrico (GIP) e o peptídeo 1 similar ao glucagon (GLP-1), os mais importantes. A colecistocinina (CCK), a gastrina, a secretina e os aminoácidos (como a arginina), também estimulam a liberação de insulina induzida pela glicose obtida por via alimentar. Por outro lado, a somatostatina e algumas substâncias inibem a secreção de insulina. Assim, a secreção de insulina está sujeita a um elaborado controle. O principal regulador é a glicose, mas nutrientes, hormônios e neurotransmissores também podem interferir na liberação de insulina.
As células beta secretam insulina em resposta ao aumento da glicemia. A insulina promove a entrada da glicose nas células e sua conversão em moléculas armazenadoras de energia (glicogênio e gordura). A insulina também auxilia a entrada de aminoácidos nas células e a produção de proteínas celulares. Sendo assim, ela promove a deposição de moléculas armazenadoras de energia após as refeições, quando a glicemia aumenta. Essa ação é antagônica à do glucagon, e a secreção deste, normalmente, diminui quando a insulina aumenta. Em contrapartida, durante períodos de jejum, a secreção de insulina diminui, enquanto a de glucagon aumenta.
O glucagon é produzido pelas células alfa das ilhotas pancreáticas, pela ação da enzima pró-hormônio convertase-2, e constitui o fator endócrino mais importante para o fornecimento de energia aos tecidos no período pós-absortivo. A molécula do pró-glucagon também pode ser produzida por células L do intestino e por células do hipotálamo. Embora a secreção de glucagon seja estimulada pela presença de muitos aminoácidos, a glicose exerce um efeito oposto, inibindo a sua síntese e secreção. Dessa forma, quanto maior a proporção de carboidratos em uma refeição, menor quantidade de glucagon será secretada. Já uma refeição predominantemente proteica resultará em maior secreção de glucagon. Além dos aminoácidos, as catecolaminas, os hormônios gastrointestinais e os glicocorticoides também estimulam a secreção de glucagon.
A principal função do glucagon é manter a glicemia durante o jejum, sendo considerado o mais potente agente glicogenolítico hepático. As células alfa secretam o glucagon em resposta à queda da glicemia. Nesse caso, o glucagon estimula o fígado a hidrolisar o glicogênio em glicose (glicogenólise), disponibilizando glicose para o sangue e, com isso, promovendo um aumento da glicemia. Além disso, o glucagon estimula a hidrólise da gordura armazenada (lipólise) e a consequente liberação de ácidos graxos livres no sangue, que, junto a outros hormônios, também estimula a conversão dos ácidos graxos em corpos cetônicos, que podem ser secretados pelo fígado na corrente sanguínea e utilizados por outros órgãos como fonte de energia. Dessa forma, o glucagon é um hormônio que ajuda a manter a homeostasia durante períodos de jejum, quando as reservas energéticas do corpo devem ser utilizadas. A meia-vida do glucagon na circulação é de três a seis minutos, sendo degradado no fígado.
A secreção dos hormônios insulina e glucagon é regulada pelas concentrações de glicose sanguínea. Enquanto o glucagon eleva a concentração sanguínea de glicose, quando está abaixo do normal, a insulina atua reduzindo as concentrações de glicose no sangue, quando estão muito elevadas. Assim, a hipoglicemia estimula a secreção de glucagon pelas células alfa das ilhotas pancreáticas. O glucagon age nos hepatócitos, convertendo glicogênio em glicose e formando glicose a partir do ácido láctico e de determinados aminoácidos. Como resultado, os hepatócitos liberam glicose no sangue de maneira mais rápida, e a glicemia se eleva. Caso a glicemia continue subindo, as concentrações altas de glicose no sangue (hiperglicemia) inibem a liberação de glucagon. A hiperglicemia também estimula a secreção de insulina pelas células beta. A insulina pode agir em várias células do nosso organismo para acelerar a difusão facilitada da glicose para as células. A glicose nas células é utilizada para: converter a glicose em glicogênio; para intensificar a captação de aminoácidos pelas células e aumentar a síntese de proteína; para acelerar a síntese de ácidos graxos, com o propósito de retardar a conversão de glicogênio em glicose e tornar mais lenta a formação de glicose a partir do ácido láctico e de aminoácidos. Desse modo, como consequência do aumento da captação de glicose pelas células, há uma queda das concentrações de glicose no sangue. Quando as concentrações sanguíneas de glicose estão abaixo do normal, ocorre a inibição da liberação da insulina e o estímulo à liberação de glucagon.
Siga em Frente...
O diabetes mellitus (DM) é um distúrbio metabólico na qual não há produção de quantidade suficiente de insulina ou o organismo não responde adequadamente à insulina, acarretando hiperglicemia persistente, ocasionando complicações a longo prazo. O DM pode ser classificado de acordo com sua etiologia. O diabetes mellitus tipo 1 (DM1) é uma doença autoimune, na qual ocorre a destruição progressiva e total das células beta pancreáticas, ocasionando uma deficiência, inicialmente parcial, mas que progride para ausência total da produção de insulina. Na ausência de insulina, os tecidos sensíveis a esse hormônio não conseguem captar e armazenar glicose, aminoácidos e lipídios, até mesmo na presença de concentrações plasmáticas circulantes elevadas dessas moléculas. Essa doença é frequentemente diagnosticada em crianças, adolescentes e, em alguns casos, em adultos jovens, afetando igualmente homens e mulheres. Os sintomas incluem polidipsia, poliúria e polifagia, fadiga, fraqueza, perda de peso inexplicada, visão turva e infecções frequentes. O tratamento consiste em insulinoterapia a partir do diagnóstico da doença, para controle das concentrações de glicose no sangue, monitoramento regular da glicemia e mudanças no estilo de vida (alimentação saudável e atividades físicas regulares).
O diabetes mellitus Tipo 2 (DM2) corresponde a 90 a 95% de todos os casos da doença, possui etiologia complexa e multifatorial, envolvendo componentes genéticos e ambientais, dentre eles, hábitos dietéticos e sedentarismo, que contribuem para a obesidade e se destacam como os principais fatores de risco. Essa doença afeta, geralmente, indivíduos com mais de 40 anos de idade, embora casos pediátricos e em adultos jovens estejam rapidamente aumentando, principalmente devido à obesidade. A progressão para o DM2 frequentemente inicia com o pâncreas produzindo insulina, muitas vezes em quantidades até maiores que o normal, principalmente no início da doença. Entretanto, o organismo acaba criando resistência aos efeitos da insulina, de modo que a insulina circulante acaba não sendo suficiente para atender às necessidades do organismo. Com o aumento da idade e de peso, os tecidos que antes eram normalmente responsivos à insulina tornam-se relativamente resistentes à ação do hormônio e necessitam de níveis aumentados de insulina para responder de modo apropriado. Por isso, os pacientes com DM2 apresentam concentrações circulantes de insulina mais altos que o normal, e essas concentrações não são suficientes para superar a resistência à insulina nos tecidos-alvo. Com a progressão da doença, há uma diminuição da capacidade de produção de insulina pelo pâncreas. O DM2 apresenta alguns sintomas que também são observados no DM1, como polidipsia, poliúria, polifagia, visão turva, infecções frequentes, retardo na cicatrização de feridas, fadiga e fraqueza. Contudo, na DM2 também se observa o ganho de peso, diferindo do DM1. O tratamento do DM2 costuma incluir mudanças no estilo de vida (perda de peso, dieta e atividade física regular), monitoramento regular da glicemia e uso de medicamentos hipoglicemiantes.
Um outro tipo de diabetes é o gestacional, que é uma intolerância à glicose de gravidade variável, que se inicia durante a gestação, sem ter previamente preenchidos os critérios diagnósticos de DM. A gestação consiste em condição diabetogênica, uma vez que a placenta produz hormônios hiperglicemiantes e enzimas placentárias que degradam a insulina, com consequente aumento compensatório na produção de insulina e na resistência à insulina, podendo evoluir com disfunção das células beta. Além disso, algumas mulheres podem já ter uma predisposição genética ao diabetes ou outros fatores de risco, como excesso de peso ou obesidade. O diagnóstico é realizado, geralmente, no segundo ou terceiro trimestres da gestação, e pode ser uma condição transitória ou persistir após o parto. Mulheres que com diabete melito gestacional têm maior risco de complicações da gestação (pré-eclâmpsia, aborto espontâneo, entre outras), mortalidade e anormalidades fetais (macrossomia fetal, hipoglicemia, hipocalcemia, policitemia e hiperbilirrubinemia). Nessas mulheres, também há um risco maior de desenvolvimento de DM2. Portanto, é necessário o acompanhamento pós-parto. Existem outras condições que podem gerar um quadro de DM, como: defeitos genéticos que resultam na disfunção das células beta; defeitos genéticos na ação da insulina; doenças do pâncreas exócrino, como a pancreatite; entre outras.
O diagnóstico de DM deve ser determinado pela presença de hiperglicemia, a partir da análise dos valores glicêmicos de jejum, dos valores obtidos no teste de tolerância oral à glicose ou do valor glicêmico obtido a qualquer hora do dia (glicemia casual). O DM não controlado adequadamente, pode levar a uma série de complicações de saúde a longo prazo, como: 1) risco aumentado de desenvolver doenças cardiovasculares, como doença arterial coronariana, ataque cardíaco e acidente vascular encefálico; 2) neuropatia, uma vez que o DM pode causar danos nos nervos, especialmente nas extremidades do corpo, resultando em sintomas como formigamento, dormência, dor ou fraqueza nos membros, podendo levar a complicações mais graves, como úlceras nos pés e amputações; 3) retinopatia diabética, devido danos nos vasos sanguíneos da retina, acarretando problemas de visão, incluindo retinopatia diabética, catarata, glaucoma e até perda de visão; 4) nefropatia diabética, uma vez que o DM é uma das principais causas de doença renal crônica e, desse modo, danos aos pequenos vasos sanguíneos dos rins podem levar à insuficiência renal e à necessidade de diálise ou transplante renal; 5) má circulação nos pés, reduzindo o fluxo sanguíneo nessa região, aumentando o risco de infecções, úlceras e, em casos graves, amputações; 6) infecções na pele, como furúnculos e infecções fúngicas, devido ao aumento dos níveis de glicose no sangue, que podem servir como nutrição, propiciando o crescimento bacteriano e fúngico; e 7) problemas dentários, pois aumenta o risco de doença periodontal, cárie dentária e outras condições dentárias devido ao aumento da glicose na saliva, que pode servir de fonte de energia para as bactérias na boca.
Agora que você conheceu as principais características funcionais do pâncreas endócrino, você é capaz de compreender a importância do conhecimento desse tema para uma atuação profissional adequada e segura, visando o bem-estar e a promoção da saúde.
Vamos Exercitar?
Agora que você conheceu e aprendeu a respeito das principais características funcionais do pâncreas endócrino e sua importância para o organismo humano, vamos retomar a situação-problema. A partir de agora, vamos considerar que você seja o Gabriel, um aluno de graduação na área de saúde que está fazendo um estágio em uma Unidade Básica de Saúde de sua cidade. Nesse momento, você está acompanhando o caso de Maria, 52 anos, que tem diabetes mellitus tipo 2. Maria é obesa e vem sendo tratada na unidade há dois anos. Ela faz uso de insulina diariamente, além de hipoglicemiantes orais após as refeições. Porém, apesar do tratamento, Maria não tem seguido uma dieta adequada e não pratica exercícios físicos regularmente. Nessa consulta de acompanhamento, Maria demonstrou preocupação com sua saúde após ler notícias na internet sobre os possíveis impactos do diabetes mal controlado. Ela expressou várias dúvidas sobre sua condição e seu tratamento, também pediu alguns esclarecimentos a você. Maria gostaria de saber: “por que ela precisava aplicar insulina diariamente? Além da insulina, por que era necessário o hipoglicemiante oral após as refeições? Quais seriam de fato as consequências de não seguir um tratamento adequado para o diabetes? É verdade que ela poderia ficar cega?”.
Agora, você é capaz de responder a todos esses questionamentos. Vamos lá!
Primeiramente, é importante lembrar que o diabetes mellitus tipo 2 (DM2) é o tipo mais comum de diabetes e está frequentemente associado à obesidade e ao envelhecimento. O DM 2 tem início insidioso e se caracteriza, principalmente, por resistência à insulina e deficiência parcial de secreção de insulina pelas células beta pancreáticas. O tratamento da DM2 consiste em uso de hipoglicemiantes e insulinoterapia, associados a mudanças no estilo de vida. A insulina é essencial para ajudar o corpo a regular as concentrações de glicose no sangue. Como Maria tem diabetes mellitus tipo 2, seu corpo não produz insulina suficiente ou não consegue utilizá-la de forma eficaz. Portanto, a insulina que ela aplica diariamente é necessária para ajudar a controlar as concentrações de glicose no seu sangue e manter sua saúde. Além da insulina, Maria faz uso de hipoglicemiantes orais após as refeições, estes são medicamentos que auxiliam na redução das concentrações de glicose no sangue após as refeições, complementando o efeito da insulina. Eles ajudam a melhorar a sensibilidade à insulina ou a diminuir a produção de glicose pelo fígado. Portanto, o hipoglicemiante oral após as refeições é importante para a manutenção das concentrações de glicose no sangue dentro do normal, prevenindo complicações do diabetes. O diabetes mal controlado pode ter várias consequências graves para a sua saúde a longo prazo. Isso inclui um risco aumentado de desenvolver doenças cardiovasculares, problemas renais, danos nos nervos, infecções crônicas e problemas de visão, como a retinopatia diabética, que pode se agravar e levar à perda da visão. Se o diabetes não for tratado adequadamente, essas complicações podem se tornar ainda mais graves e afetar significativamente a qualidade de vida do indivíduo.
Saiba Mais
Anatomia e histologia do pâncreas
O pâncreas, além de suas funções exócrinas na digestão, possui as ilhotas de Langerhans, que são seus componentes endócrinos. Nessas ilhotas, diferentes células produzem hormônios distintos, como insulina e glucagon, que desempenham papéis essenciais na regulação das concentrações de glicose no sangue e, consequentemente, no metabolismo dos carboidratos, lipídios e proteínas. Compreender a anatomia e histologia do pâncreas endócrino é fundamental para o diagnóstico e tratamento de distúrbios como diabetes mellitus e outras condições endócrinas relacionadas, permitindo um cuidado abrangente e eficaz aos pacientes.
Para explorar mais sobre a histologia do pâncreas endócrino e implicações nas suas ações fisiológicas, leia:
- KIMURA, E. T. Glândulas endócrinas. In: JUNQUEIRA, L. C. U.; CARNEIRO, J. Histologia básica: texto e atlas. 14. ed. Rio de Janeiro: Guanabara Koogan, 2023. cap. 20, p. 436-437.
Fisiologia do glucagon e insulina
O pâncreas endócrino é responsável pela síntese e secreção dos hormônios insulina e glucagon. A insulina, produzida pelas células beta do pâncreas, promove a captação de glicose pelas células, diminuindo as concentrações de glicose no sangue. Por outro lado, o glucagon, produzido pelas células alfa do pâncreas, estimula a liberação de glicose pelo fígado, elevando as concentrações de glicose no sangue. Assim, o equilíbrio entre esses hormônios é essencial para a manutenção das concentrações de glicose no organismo.
Para saber mais sobre os hormônios produzidos pelo pâncreas endócrino, leia:
- MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021. cap. 7, p. 168-179.
Diabetes mellitus, terapia insulínica e antidiabéticos orais
O diabetes mellitus é uma condição crônica caracterizada por concentrações elevadas de glicose no sangue. O tratamento inclui terapia insulínica para pacientes com diabetes tipo 1 e, em alguns casos, para diabetes tipo 2. Além disso, são utilizados antiglicemiantes orais, como metformina, para ajudar a controlar as alterações nas concentrações de glicose no sangue e, dessa forma, prevenir complicações relacionadas à doença, proporcionando melhor qualidade de vida para os pacientes.
Para saber mais sobre o tratamento do diabetes mellitus, acesse na Biblioteca Virtual:
- WHALEN, K. Antidiabéticos. In: WHALEN, K.; FINKEL, R.; PANAVELIL, T. A. Farmacologia ilustrada. 6. ed. Porto Alegre: Artmed, 2016. cap. 25, p. 335-348.
Referências Bibliográficas
CURI, R.; PROCOPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10. ed. Rio de Janeiro: Guanabara Koogan, 2023.
MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.
Encerramento da Unidade
Anatomofisiologia e Patologia das Glândulas Endócrinas
Videoaula de Encerramento
Olá, estudante! Nesta videoaula, você irá continuar a jornada fascinante pelo sistema endócrino, explorando conceitos essenciais que são fundamentais para a sua prática profissional. Você já desvendou vários mistérios que envolvem esse sistema, seus componentes e seu funcionamento e mergulhou no estudo das patologias que podem acometer esse sistema. Agora, convido você a continuar nessa jornada! Assista à videoaula e descubra como o conhecimento sobre o sistema endócrino pode enriquecer e transformar a sua prática profissional. Não perca!
Ponto de Chegada
Para desenvolver a competência desta unidade, que é "assimilar as características anatômicas e fisiológicas das principais glândulas do sistema endócrino, identificando como funcionam os seus mecanismos de síntese e liberação hormonais. Conhecer como agem as principais famílias de fármacos utilizadas no mercado e patologias associadas a essas estruturas do sistema endócrino", você primeiramente conheceu detalhadamente a anatomia e a histologia do sistema endócrino. Entendeu como cada estrutura contribui para o funcionamento adequado do sistema e como as características histológicas influenciam sua função. Além disso, você analisou em profundidade como ocorre a síntese dos diferentes tipos de hormônios produzidos pelas diferentes glândulas desse sistema, compreendendo os mecanismos fisiológicos envolvidos em cada etapa. Por fim, você explorou as principais patologias associadas ao sistema endócrino, investigando suas causas, sintomas e consequências fisiológicas. Assim, a abordagem desses assuntos ao longo da unidade permitiu consolidar seu entendimento a respeito e incentivá-lo a refletir sobre os assuntos abordados e como aplicar esses conhecimentos em contextos práticos.
Reflita
|
É Hora de Praticar!
Nessa semana, um grupo de estudantes da área da saúde irá acompanhar a rotina do Ambulatório do Hospital de sua Universidade. Uma das atividades a ser realizada durante esse período será o acompanhamento de alguns casos clínicos de pacientes atendidos pelo Hospital Universitário. No primeiro dia de atividades, um dos alunos do grupo acompanhou o caso do paciente S.W.T., 45 anos. O paciente chegou ao Ambulatório apresentando crise hipertensiva, taquicardia, palidez e cefaleia. Negou tabagismo e etilismo, não fazia uso de medicamentos. O paciente possuía histórico de várias internações prévias por crise hipertensiva, mas sem um diagnóstico conclusivo. Os exames laboratoriais mostraram concentrações urinárias elevadas de catecolaminas e seus metabólitos. Na ressonância magnética, foram encontradas lesões nodulares na topografia das glândulas adrenais direita e esquerda. Devido às grandes proporções das massas nodulares, optou-se pela remoção cirúrgica das adrenais. A análise anatomopatológica das glândulas removidas evidenciou a presença de neoplasias compatíveis com feocromocitoma, diagnóstico que foi conclusivo diante dos demais achados clínicos e laboratoriais.
Para incentivar as discussões a respeito do caso apresentado, o supervisor da equipe sugeriu que os estagiários iniciassem as discussões relembrando alguns conceitos anatômicos e funcionais das glândulas suprarrenais. Para tal, o supervisor da equipe levantou os seguintes questionamentos aos alunos de graduação: “você saberia explicar o que é feocromocitoma? Qual seria a relação entre os sintomas apresentados pelo paciente e as glândulas adrenais?”.
Reflita
Como você, no lugar desses alunos, responderia a todos esses questionamentos?
Resolução do estudo de caso
Você já viu vários conceitos importantes a respeito das glândulas adrenais. Você já sabe que essas glândulas são responsáveis pela produção de diferentes hormônios esteroides. A porção cortical da glândula produz mineralocorticoides, glicocorticoides e androgênios, enquanto a porção medular é responsável pela produção de catecolaminas. Ainda, você já sabe que alterações no funcionamento dessas estruturas resultam em diferentes efeitos fisiológicos que podem ser deletérios ao organismo. Dentre as patologias associadas às glândulas adrenais, temos os feocromocitomas. Estes são tumores que se originam nas células cromafins e podem ou não estar restritos à porção medular da adrenal. Esses tumores secretam grandes quantidades de catecolaminas, levando a vários efeitos metabólicos, sendo a principal manifestação clínica a presença de hipertensão arterial. Outros sintomas como taquicardia, cefaleia, episódios de sudorese excessiva, ansiedade, tremores e intolerância à glicose também podem estar presentes. De fato, as catecolaminas aumentam a frequência cardíaca (taquicardia), promovem vasoconstrição e aumentam a resistência periférica total, determinando a elevação do débito cardíaco e aumento da pressão arterial. O diagnóstico do feocromocitoma é realizado por meio da história clínica, evidenciando sinais de tônus adrenérgico aumentado, detecção laboratorial de quantidades aumentadas de catecolaminas e seus metabólitos na urina, bem como uso de exames de imagem para detecção da presença de massas tumorais. O tratamento dessa patologia geralmente é cirúrgico, com remoção das glândulas adrenais, associada à prescrição de glicocorticoides e mineralocorticoides sintéticos. Por não serem vitais ao organismo, as catecolaminas não são repostas no tratamento; contudo, a não reposição das catecolaminas pode resultar em alguns indivíduos em uma resposta adaptativa a estímulos estressores agudos menos eficaz.
Dê o play!
Assimile
Olá, estudante! Você está convidado a embarcar a partir de agora na jornada fascinante pelo sistema endócrino, explorando as informações ricas e instigantes presentes neste infográfico. Aproveite as informações sobre o córtex adrenal. Vamos lá?
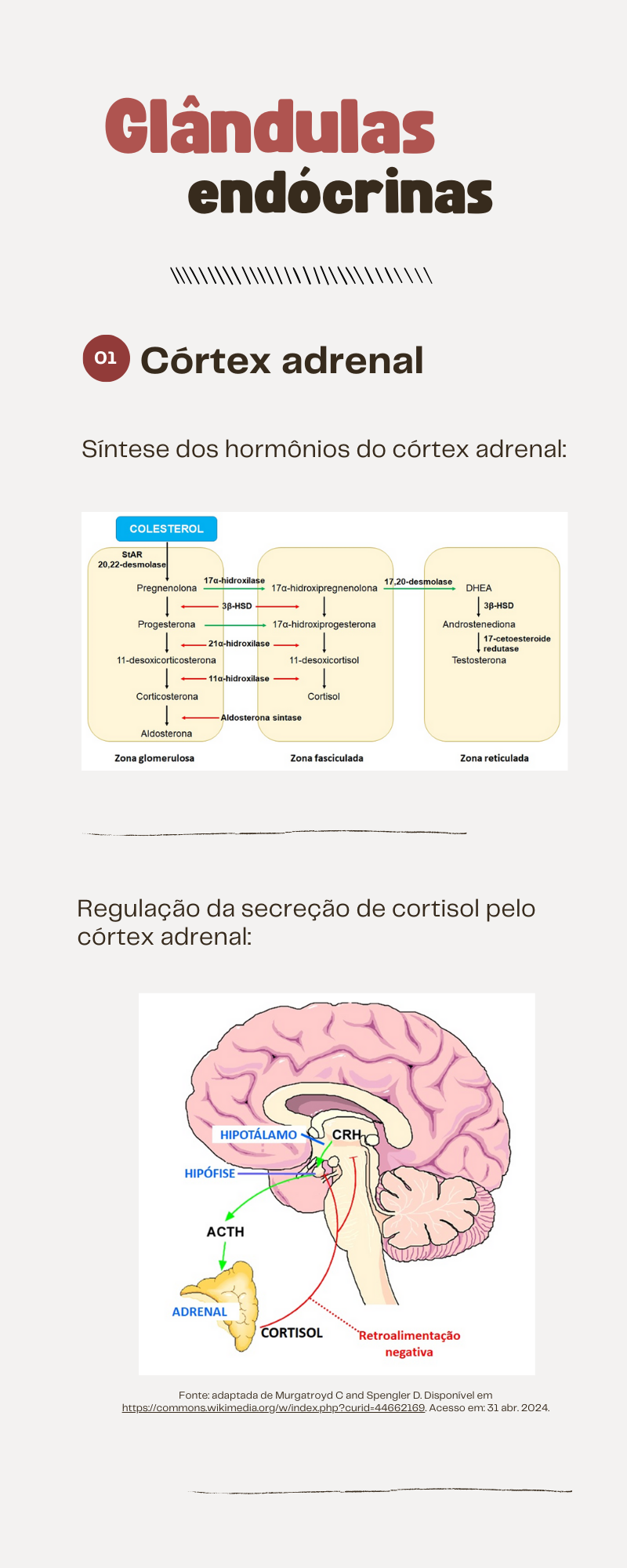
Referências
CURI, R.; PROCOPIO, J. Fisiologia básica. 2. ed. Rio de Janeiro: Guanabara Koogan, 2017.
KUMAR, V.; ABBAS, A. K.; ASTER, J. C. Robbins & Cotran: patologia: bases patológicas das doenças. 10. ed. Rio de Janeiro: Guanabara Koogan, 2023.
MOLINA, P. E. Fisiologia endócrina. 5. ed. Porto Alegre: AMGH, 2021.
SILVERTHORN, D.U. Fisiologia humana: uma abordagem integrada. 7. ed. Porto Alegre: Artmed, 2017.
TORTORA, G. J.; DERRICKSON, B. Princípios de anatomia e fisiologia. 16. ed. Rio de Janeiro: Guanabara Koogan, 2023.