Introdução à Química e ao Universo Atômico e Molecular
Aula 1
Átomos e Modelos Atômicos
Átomos e modelos atômicos
Olá, estudante! Nesta videoaula você irá conhecer a matéria e seus princípios básicos, iniciando nosso estudo com os átomos e a evolução dos modelos atômicos, assim como os números quânticos e a distribuição eletrônica. Esse conteúdo é importante para a sua prática profissional, pois é crucial para guiar descobertas em pesquisa, desenvolvimento de materiais, diagnóstico médico e controle de processos, fundamentando avanços nas ciências e tecnologias. Esteja pronto para embarcar nesta jornada de aprendizado! Vamos lá!
Ponto de Partida
Aprendemos muito cedo na escola que nosso corpo é feito de células, porém, se olharmos mais de perto, veremos que nossas células são feitas de moléculas. Algumas são moléculas grandes, como as proteínas, outras pequenas, como a molécula de água ( ). As moléculas que fazem parte do nosso corpo são feitas de átomos, em maior proporção por carbono, hidrogênio, oxigênio e nitrogênio, no entanto, existem outros elementos que são necessários à vida, como o ferro que está na estrutura da mioglobina, uma proteína que é responsável pelo transporte de oxigênio em nosso sangue. Este ferro é o mesmo tipo de átomos de ferro que compõem vigas para uma construção.
Nosso corpo e a viga são feitos de átomos e todos os átomos conhecidos até hoje apresentam a mesma estrutura, um núcleo e uma eletrosfera. Nesta aula, você será apresentado ao átomo, ao universo atômico e molecular, a como os átomos são compostos, como estas informações são organizadas e quais os princípios básicos de reatividade.
Para aplicar esses conteúdos, você precisará avaliar um processo industrial, onde a remoção de contaminantes é uma etapa-chave do processo, melhorando a pureza de diversos produtos, sendo que diferentes técnicas de purificação podem ser aplicadas. Assim, você irá se colocar no lugar de um professional da engenheira que trabalha numa fábrica de ração animal. Pelo processo de fabricação, muitos minérios estavam contaminando o produto e danificando alguns equipamentos. Tentando uma alternativa para o problema, o diretor da empresa lhe consultou sobre a compra de um tambor magnético de via úmida. Para saber qual tipo de contaminantes o ímã irá remover, você precisa saber quais substâncias apresentam atração por ímãs e assim emitir um parecer sobre a compra do equipamento. Bons estudos!
Vamos Começar!
A química esteve presente em toda a história da humanidade. No início, a química não era vista como ciência, mas como algo utilitarista, isto é, desenvolvia o conhecimento para resolver problemas sociais. Foi assim com o desenvolvimento dos primeiros materiais de argila obtidos pelo homem após descobrir o fogo, com o surgimento de tintas primitivas e de produtos de cerâmica no final do período neolítico e com todo o avanço dos egípcios antigos, que desenvolveram os perfumes, alguns remédios, papiros e diversas tintas, entre outras coisas. Hoje, a química é uma ciência e seus avanços e descobertas permitiram muitas melhorias no dia a dia, estando intrinsicamente relacionados com a melhora da qualidade de vida.
Quando você tem uma dor de cabeça e toma um analgésico, aquele comprimido foi um avanço da química. Ao colocar uma roupa, o material com o qual ela é confeccionada foi um avanço da química. Beber uma água tratada que não causa problemas de contaminação ao seu corpo, só é possível pelo avanço da química. A tecnologia tem progredido com o avanço da química, afinal as baterias de seu celular está cada vez durando mais, não é mesmo?
As primeiras considerações científicas sobre a constituição da matéria foram feitas por Robert Boyle (1627-1691), em 1661, com a primeira definição de elemento químico como um corpo não misturado ou simples, que não pode ser feito de outro corpo e que a matéria era composta por várias combinações de diferentes elementos (KOTZ et. al., 2014). A partir disso, Dalton realizou experimentos medindo a massa de diversos compostos, observando que a quantidade dos elementos permanecia sempre a mesma, desse modo, Dalton propôs um modelo para composição da matéria, que seria formada de minúsculas partículas indivisíveis, sendo os átomos de cada elemento iguais. Para diferentes elementos, os átomos teriam massas distintas e a combinação química ocorreria quando os átomos formassem uma união firme, sendo que nestas reações os átomos não seriam criados e nem destruídos. O modelo atômico de Dalton ficou conhecido como bola de bilhar, por considerar o átomo uma bola maciça.
A partir desse modelo e por meio da realização de experimentos, Thomson, em 1897, identificou uma espécie subatômica. Esta espécie foi denominada elétron e em 1898. Thomson propôs um novo modelo para o átomo, em que havia uma massa positiva encrostada de cargas negativas, este modelo ficou conhecido como pudim de passas.
Os próximos avanços em termos de modelos atômicos, estão relacionados a história da radioatividade. Ernest Rutherford, a partir de seus conhecimentos sobre radioatividade, propôs um experimento em que uma fina folha de platina era bombardeada com um feixe de partículas . Com este experimento, Rutherford propôs um modelo alternativo ao de Thomson, sendo o átomo composto por um núcleo contendo partículas positivas, rodeado por elétrons.
Quase que uma década depois de sua proposta, os prótons foram identificados. Sabendo que duas partículas opostas se atraem, o que deveria acontecer com o átomo de Rutherford? O átomo se colapsaria já que prótons e elétrons são partículas subatômicas de cargas opostas e teriam uma grande força de atração. Não é o que acontece, certo? O universo continua aí ao seu redor! Niels Bohr e Arnold Sommerfeld propuseram que os elétrons estavam em movimento, percorrendo órbitas elípticas. Bohr, utilizando alguns conceitos desenvolvidos por Planck e Einstein em diversos experimentos, propôs que apenas algumas trajetórias eram possíveis para o elétron, estas trajetórias é o que você conhece por camadas eletrônicas, que compõem a eletrosfera.
Esse átomo é formado por duas regiões bem definidas (núcleo e eletrosfera), desse modo, você pode calcular exatamente onde o elétron se encontra e sua energia? A resposta para esta pergunta é não. Há um princípio muito conhecido em química que diz que não podemos conhecer com precisão a posição e a velocidade do elétron, o chamado princípio da incerteza de Heisenberg.
Até agora você aprendeu sobre o átomo como partícula, porém, ele também se comporta como onda. Em 1925, baseado em experimentos de Planck e Einstein, De Broglie propôs que elétrons de massa , movendo-se com uma velocidade , apresenta um comprimento de onda , sendo em que é a constante de Planck, ou seja, podia ser tratado como uma onda. A partir destas considerações e do efeito fotoelétrico estudado por Einstein, Erwin Schrödinger descreveu o modelo ondulatório para o elétron do hidrogênio utilizando uma função matemática (função de onda), dando origem ao modelo atômico quântico, extrapolado para os demais átomos.
Lembre-se de que tudo isso de maneira teórica. A equação de Schrödinger é sobre determinar a posição e a energia dos elétrons, como isso não é possível, o resultado da equação é uma região onde se tem uma maior probabilidade de encontrar um elétron com determinada energia. Quando chegamos em 90% de chance de encontrar um elétron, temos um orbital atômico. Dependendo da camada eletrônica, temos diferentes energias, sendo os elétrons menos energéticos encontrados nas camadas mais próximas do núcleo. As camadas foram denominadas por Schrödinger de número quântico principal, sendo definido que cada camada tem um limite de orbitais possíveis. A reatividade e características de um átomo são determinadas, principalmente, por seus elétrons da camada mais externa, chamada camada de valência.
Siga em Frente...
Ao trabalhar a equação de Schrödinger, podemos obter três dados que funcionam como o endereço do elétron, os chamados números quânticos. Ao descrevermos estes valores, saberemos qual é a região onde tem maior probabilidade de se encontrar um determinado elétron. O primeiro dado é sobre as camadas que contêm os elétrons, o número quântico principal, chamado de n, sendo números inteiros (n= 1, 2, 3, 4, 5, ...). Estas camadas possuem subcamadas, que são os diferentes tipos de orbitais, representados pelo número quântico de momento angular (), sendo que . Além de números, as subcamadas foram nomeadas com letras que correspondem a determinadas características. Como estas palavras estão em inglês, é importante apenas saber que temos os orbitais s (). você pode notar que os orbitais possuem orientações espaciais. Este dado é chamado de número quântico magnético (), podendo assumir valores de a . O último número quântico diz respeito ao movimento do elétron ao longo do seu eixo, o número quântico de spin (). Apenas dois valores são possíveis, e , uma vez que o elétron pode girar apenas no sentido horário e anti-horário.
Você foi apresentado aos quatro números quânticos: principal (n), momento angular (), magnético () e de spin (). Lembre-se de que os três primeiros são resultados da equação de Schrödinger e o último ocorre devido ao movimento dos elétrons. Segundo o princípio da exclusão de Pauling, dois elétrons não podem ter o mesmo conjunto de números quânticos, ou seja, temos dois elétrons com n = 3 (os dois na camada 3), (os dois no orbital p), (os dois com a mesma orientação espacial ou x, ou y, ou z), porém um com e outro com (cada um gira em um sentido). Em outras palavras, você pode dizer que o princípio da exclusão de Pauling fala que apenas dois elétrons podem ocupar 1 orbital. Os orbitais são representados por caixas, os elétrons por setas e usamos a nomenclatura descrita na Figura 1.1 para indicarmos os números quânticos.
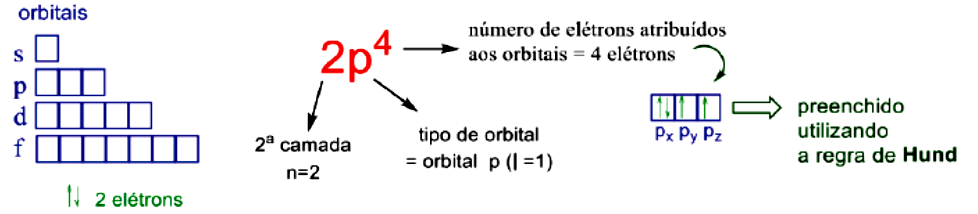
Então, como vimos na figura 1.1, a descrição significa que temos quatro elétrons em orbitais p na camada 2. Os orbitais de um mesmo tipo (como os três orbitais p: , e ) são chamados de degenerados. O preenchimento de orbitais degenerados ocorre seguindo a regra de Hund que diz que devemos colocar um elétron em cada orbital e depois voltar ao primeiro e seguir preenchendo.
Como você distribuiria os elétrons ao longo das camadas e subcamadas? Este processo é chamado de distribuição eletrônica, sendo que devemos seguir o princípio da construção, colocando os primeiros elétrons na camada menos energética. A primeira camada possui n = 1, apenas 1 orbital s, com dois elétrons (lembre-se do princípio da exclusão de Pauling). Na segunda camada menos energética, n = 2, há 1 orbital s e 3 orbitais p, o orbital s é menos energético que os orbitais p, logo, preenchemos primeiramente o orbital s e depois os orbitais p. O preenchimento dos orbitais p deve seguir a regra de Hund. Isto significa que um átomo com seis elétrons tem (dois elétrons no orbital s da primeira camada), (dois elétrons no orbital s da segunda camada), (dois elétrons no orbital p da segunda camada, um em e outro em ).
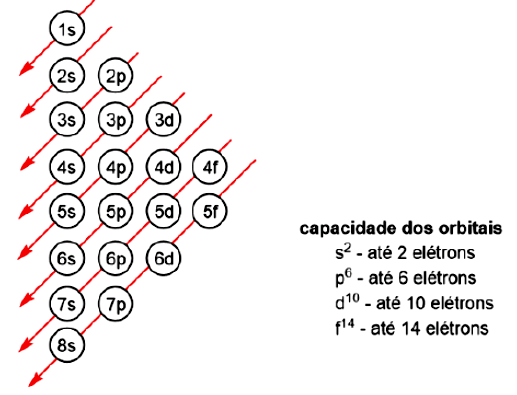
As energias das diferentes camadas e orbitais foram calculadas experimentalmente, e, para você definir qual orbital é preenchido primeiro, deve utilizar um diagrama de ordem de preenchimento das subcamadas (Figura 1.2). Neste diagrama, as camadas e subcamadas são preenchidas seguindo as setas vermelhas, iniciando por 1s, depois 2s, depois, 2p, 3s, seguido de 3p, 4s etc.
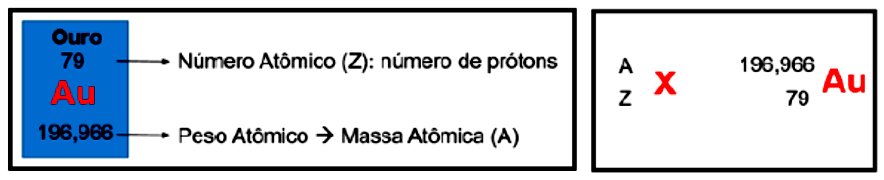
Você já conhece o átomo como é definido atualmente: um núcleo contendo prótons, nêutrons e uma eletrosfera, contendo os elétrons. O número de prótons que um átomo possui é chamado de número atômico, enquanto a massa de um átomo é chamada massa atômica. A massa atômica é relativa, ou seja, determinada por convenção. Os químicos tentaram medir os átomos de diversas maneiras, a melhor delas foi atribuir uma massa relativa igual a 1 aos prótons e aos nêutrons (lembre-se de que a massa de um elétron é desprezível). Com isso, o carbono passa a ter massa igual a 12 com seis prótons e seis nêutrons. Medidas experimentais determinaram que o oxigênio é 1,33 vezes mais pesado que o carbono, de fato, com oito prótons e oito nêutrons, a massa do oxigênio é igual a 16.
A unidade de medida de massa atômica é o u, sendo que 1u corresponde a da massa do carbono, porém, em muitos lugares você irá encontrar esta grandeza como adimensional.
A Figura 1.3 apresenta a forma como são representados os dados de número e massa atômicos, tanto na tabela periódica quanto fora dela. Uma espécie que possui o mesmo número de prótons que outra, porém, massas atômicas distintas, é chamada de isótopo, sendo exemplos de isótopos os três diferentes átomos de hidrogênios, que pesam massa 1,00794 u, encontrados na natureza: o deutério (D, ), o trítio (T, ) e o hidrogênio (H, ). A porcentagem isotópica de cada elemento consiste em sua abundância na natureza, para o H 99,985%, D 0,015%, T 0% (não existe na natureza, apenas é gerado em laboratório).
Vamos Exercitar?
Estudante, o entendimento da estrutura dos átomos e dos processos relacionados a distribuição eletrônica são importantes para compreender o comportamento de diferentes materiais.
Assim, temos que substâncias químicas são em sua maioria diamagnéticas, ou seja, são ligeiramente repelidas por ímãs. Porém, outras substâncias são atraídas por eles, as paramagnéticas. A origem do paramagnetismo é o spin do elétron, sendo que elétrons apresentam propriedades magnéticas. Quando um átomo que possui um elétron desemparelhado é colocado em um campo magnético, duas orientações são possíveis: alinhamento dos elétrons a favor do campo ou contra o campo. Isto ocorre devido ao spin ter valor ou . Cabe ressaltar que quando o campo magnético externo é removido, a orientação dos spins permanece por pouco tempo. Algumas outras espécies, no entanto, após submetidas a campos magnéticos, mantêm esta orientação, os chamados ferromagnéticos (como ferro, cobalto e níquel). Embora compostos paramagnéticos apresentem magnetismo fraco, esta propriedade pode ser utilizada.
Para determinar se o ímã industrial irá resolver o problema de contaminação e deterioração de equipamentos, precisamos definir se as impurezas do processo são paramagnéticas/ferromagnéticas ou diamagnéticas.
Você observou que alguns dos seus contaminantes, além de compostos contendo ferro, são sais de cobre () e sais de sódio (). Para determinar se estes cátions serão ou não atraídos por um ímã forte, temos que fazer suas distribuições eletrônicas:
→ , camada de valência , em que orbital é o mais energético. Por apresentar um elétron desemparelhado, o cátion cobre +2 é paramagnético.
→ , camada de valência , em que orbital é o mais energético. Por apresentar apenas elétrons emparelhados, o cátion sódio é diamagnético.
Como compostos de ferro são um grande problema em seu processo e ocorre a remoção de sais de cobre com o uso do ímã na indústria, você entregou um parecer favorável a compra do equipamento.
Você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre modelos atômicos, acesse a biblioteca virtual e faça a leitura do capítulo 2, Átomos, moléculas e íons, do livro “Química: a ciência central, disponível na biblioteca virtual [Biblioteca Virtual 3.0].
BROWN, T. L. et al. Química: a ciência central. 1. ed. São Paulo, SP: Pearson, 2016. E-book. Disponível em: https://plataforma.bvirtual.com.br. Acesso em: 22 jan. 2024.
Para compreender e aprofundar seus conhecimentos sobre estrutura do átomo, faça a leitura do artigo: “O átomo quântico”, disponível em: https://bit.ly/3u8shfR. Acesso em: 25 jan. 2024.
Por fim, aprofunde seus conhecimentos sobre distribuição eletrônica e Linus Pauling realizando a leitura do artigo: “Apresentação de metodologias alternativas para o ensino da distribuição eletrônica no átomo”, disponível em: https://www.editorarealize.com.br/editora/anais/conedu/2019/TRABALHO_EV127_MD1_SA16_ID6186_25092019055523.pdf. Acesso em: 25 jan. 2024.
Referências Bibliográficas
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
KOTZ, J. C. et al. Química geral e reações químicas.2. ed. v. 1. São Paulo: Cengage Learning, 2014.
Aula 2
Periodicidade das Propriedades Atômicas
Periodicidade das propriedades atômicas
Olá, estudante! Nesta videoaula você irá conhecer a tabela periódica, sua estrutura e propriedades, a classificação dos elementos em metais, ametais e semimetais, por fim, compreenderá as propriedades periódicas da matéria. Esse conteúdo é importante para a sua prática profissional, pois esses conhecimentos orientam a manipulação de substâncias, previsão de comportamentos químicos e inovações em diversas áreas, desde a engenharia até a medicina. Pronto para iniciar essa jornada de conhecimento? Então, vamos lá!
Ponto de Partida
Olá, estudante! Existe alguma regra ou condição para que os elementos químicos possam ser organizados na Tabela Periódica? Quais são as informações que podemos obter de um determinado elemento químico somente observando a posição que ele possui na Tabela Periódica? Quais são as propriedades periódicas e como elas podem ser empregadas na resolução de problemas do nosso cotidiano? Nesta aula você deverá estudar o que torna um elemento um bom condutor, utilizando conhecimentos sobre a tabela periódica.
Deste modo, você irá aprender sobre a tabela periódica e as propriedades periódicas dos elementos (raio atômico e iônico, afinidade eletrônica e energia de ionização). Você deve usar a tabela periódica como uma referência, não precisa decorar átomos e valores, é muito mais útil quando você a entende.
Sendo assim, imagine que você está trabalhando em um fábrica de componentes elétricos. Seu gestor começou a desenvolver novos transformadores e pediu para você selecionar quais materiais empregaria na obtenção destas peças. Você deve escolher qual o melhor material a ser empregado no transformador, ou seja, qual material apresentará maior condutividade. Entre diversas características necessárias aos condutores, é necessário que eles possuam elétrons que sejam compartilhados com facilidade, para isso eles precisam possuir uma energia de ionização baixa. Utilizando seus conhecimentos sobre a tabela periódica, você consegue propor o uso de algum elemento? Bons estudos!
Vamos Começar!
Você já deve ter visto e estudado a tabela periódica alguma vez durante seus estudos. Alguma vez já parou para pensar por que os elementos estão organizados desta maneira? A primeira organização de elementos químicos data de 1817 e, após muitas outras tentativas de organização de acordo com suas características, somente em 1969 e 1970 os cientistas Dmitri Mendeleev e Julius Lothar Meyer publicaram independentemente uma tabela considerada efetiva. Sendo que, na proposta mais amplamente conhecida, desenvolvida por Mendeleev, os elementos eram organizados pela sua massa atômica, de acordo com suas propriedades. Nesta tabela, as linhas de elementos não eram tão longas como atualmente (Kotz et al., 2014).
Com a descoberta da radioatividade e dos isótopos, descobriu-se que átomos de elementos diferentes poderiam possuir a mesma massa, sendo o argumento de organização pela massa atômica descartado. Então, em proposta mais semelhante com a atual, Mendeleev organizou os elementos pelos seus números atômicos. Com o modelo quântico do átomo, outras características passaram a ser consideradas, como a distribuição eletrônica, passando as linhas da tabela periódica a conterem determinado número de átomos até que suas propriedades químicas e físicas começassem a se repetir. Atualmente, a tabela periódica é dividida em grupos de elementos que apresentam características em comum, sendo comumente separados em metais, metaloides e não metais (Figura 1.4). Esta tabela é uma versão resumida, porém em livros didáticos você encontra tabelas completas, contendo também o nome dos elementos, massa atômica e inúmeras outras propriedades.
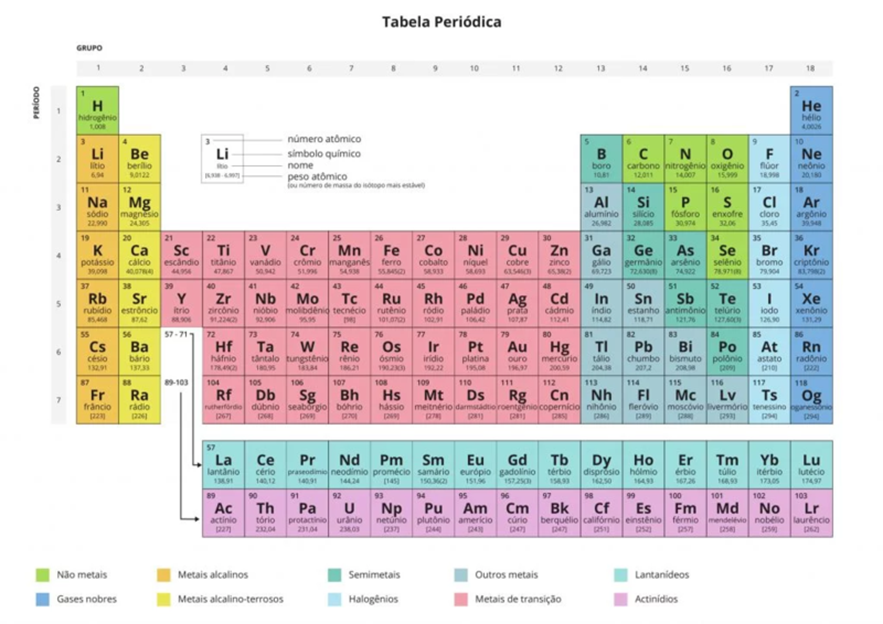
Na tabela periódica, as colunas são chamadas de grupos e denominadas por números para os grupos. As linhas da tabela periódica são chamadas períodos, sendo que ao longo deles ocorre o aumento do número atômico. Saber a localização do elemento químico nos dá várias informações sobre a distribuição eletrônica. Como já mencionamos, os metais de transição possuem seus elétrons mais energéticos (elétrons da camada de valência) nos orbitais d, enquanto os metais de transição interna nos orbitais f. Os metais do grupo principal possuem seus elétrons energéticos em orbitais s, enquanto os não metais em orbitais p (Figura 1.5).
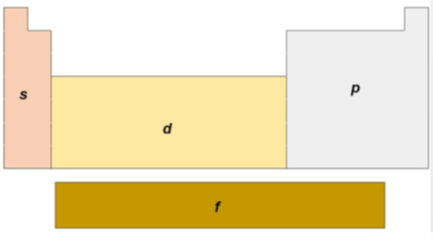
Além da distribuição eletrônica, você pode obter outras informações sobre os elementos olhando para a tabela periódica. Existem algumas propriedades que se repetem de tempos em tempos, estas são as propriedades atômicas que possuem tendências periódicas. São elas: tamanho atômico, tamanho iônico, energia de ionização e afinidade eletrônica.
Antes de começarmos a falar destas propriedades, cabe ressaltar que os valores de propriedades atômicas podem variar entre os livros didáticos, pois dependem do artigo científico original. Uma série de fatores, como a técnica aplicada e a precisão do equipamento, afeta os dados obtidos em uma pesquisa. Nesta seção, usaremos os valores apresentados por Kotz et al. (2014)
Siga em Frente...
Tamanho atômico
Você saberia dizer qual é o tamanho de um átomo? Ou ainda, você consegue dizer qual é a fronteira de um átomo? Então, como poderíamos saber qual seu tamanho? De fato, pela definição de orbitais não podemos traçar uma linha e dizer que o átomo chega até aquele ponto, nem matematicamente e nem com observações diretas. Porém, podemos utilizar medidas indiretas para conseguirmos estas informações, como analisar moléculas compostas pelos mesmos átomos. Neste caso, a definição de raio atômico é dada como metade da distância entre os centros de dois átomos.
Após cientistas medirem, experimentalmente, vários tamanhos atômicos e tabelarem estes valores (você pode conferir valores e gráficos de variação destes valores em Atkins e Jones (2009, p. 40)) foi observado que na medida que o valor de n aumenta, aumenta também o raio atômico, ou seja, o raio atômico aumenta no mesmo sentido de aumento de período ao longo de um grupo. Isso é fácil de analisarmos, se você pensar que quanto maior o n, maior o número de camadas, é natural esta tendência em aumentar o tamanho do átomo de cima para baixo na tabela periódica.
Outra observação foi que o tamanho do átomo diminui na medida que adicionamos um próton. Podemos simplificar esta observação racionalizando que na medida que ocorre o aumento em um próton, a atração com a eletrosfera é maior, o núcleo passa a atrair os elétrons mais fortemente. Desta maneira, o raio atômico diminui na medida que aumenta o número atômico em um mesmo período.
Tamanho iônico
Um íon é um elemento que perdeu ou ganhou elétrons. Sendo que ao ganhar elétrons, um átomo fica negativo e é chamado de ânion. Quando um átomo perde elétrons, ele fica positivo, sendo chamado de cátion. Você deve observar se tem um íon ou um elemento neutro ao fazer a distribuição eletrônica. Se ele perdeu um elétron, a distribuição eletrônica corresponde à distribuição observada para o elemento menos um elétron. Já se ele ganhou um elétron, corresponde à distribuição do elemento com um elétron adicional.
Existe uma variação entre o raio atômico do elemento e de seu íon, um cátion será sempre menor que o elemento de origem, enquanto um ânion será sempre maior. O raio iônico é uma propriedade periódica, em que o tamanho do íon aumenta ao longo do período. Agora se compararmos íons , , e , que possuem o mesmo número de elétrons (chamados isoelétricos), veremos que embora todos tenham 10 elétrons, possui oito prótons e raio atômico de 140 pm, possui nove prótons e raio atômico de 133 pm, possui dez prótons e raio atômico de 98 pm e possui 12 prótons e raio atômico de 79 pm. Podemos explicar os valores tão diferentes de raio atômico pelo número de prótons. Quanto maior o número de prótons, maior a atração núcleo-eletrosfera, portanto, menor o tamanho do íon.
Energia de ionização (EI)
Estando um átomo em fase gasosa, a energia de ionização é a energia necessária para a remoção de um elétron da camada de valência, levando à formação de cátions. Como é necessário fornecer energia para que ocorra a abstração do elétron, este valor é positivo (energias positivas são fornecidas ao sistema e energias negativas liberadas pelo sistema, no caso sistema é a reação).
Removendo gradativamente, em fase gasosa, 1, 2 e 3 elétrons do átomo de magnésio, temos (Figura 1.6):
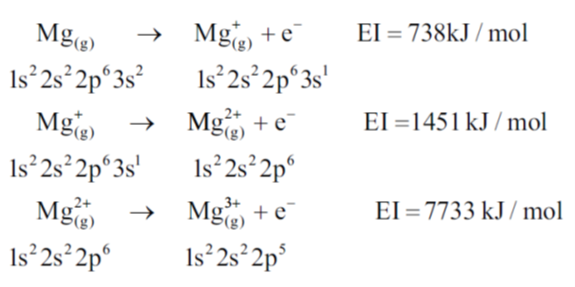
Isso significa que é necessário fornecer ao sistema 738 kJ/mol para remover o primeiro elétron do magnésio, 1451 kJ/mol para remover o segundo elétron (quase o dobro da primeira EI) e 7733 kJ/ mol na terceira (mais de cinco vezes a segunda EI). Se você olhar a distribuição eletrônica do magnésio metálico, do cátion que perdeu um elétron e do cátion que perdeu dois elétrons, verá que a primeira e a segunda perda ocorreram com elétrons da 3ª camada, enquanto o terceiro elétron é retirado de uma camada mais próxima ao núcleo. Elétrons de camadas mais internas são mais difíceis de serem removidos, devido a sua proximidade com o núcleo.
Quanto maior for o raio atômico, menor será esta energia, já que os elétrons da camada de valência estão mais afastados do núcleo. Com isso, podemos dizer que para elementos do grupo principal, a energia de ionização diminui com o aumento do período e aumenta com o aumento do número atômico. Uma exceção é o valor da energia de ionização do átomo de oxigênio ser menor que a do nitrogênio, voltando a aumentar no flúor. Quando o átomo de oxigênio está com seis elétrons na camada de valência, temos um orbital p com dois elétrons, isso causa uma certa repulsão. Ao perder um elétron, cada orbital tem apenas um elétron, diminuindo esta repulsão. Com isso, a abstração do primeiro elétron não é tão difícil como no nitrogênio (N, EI = 1402 kJ/mol) e no flúor (F, EI = 1681 kJ/mol). Este mesmo efeito é observado para o enxofre (S) e o selênio (Se) com relação aos seus vizinhos nos períodos abaixo. Este exemplo demonstra a importância da distribuição eletrônica na energia de ionização.
Afinidade eletrônica (AE)
A formação de ânions ocorre quando um átomo captura um elétron. A capacidade de um átomo capturar elétrons é avaliada como afinidade eletrônica, quando o elemento está em fase gasosa. Comumente, quando ocorre a adição de um elétron a um átomo, ocorre a liberação de energia, desta forma, quanto maior for a afinidade eletrônica, mais negativo será seu valor.
Já mencionamos que quanto maior o número atômico de um elemento ao longo do período, menor o átomo, pois há mais prótons para atrair os elétrons da camada de valência. Este mesmo efeito é observado para afinidade eletrônica. Quanto maior o número atômico ao longo do período, maior será a afinidade eletrônica. Seguindo a mesma linha de raciocínio, em um mesmo grupo, quanto mais acima o átomo se encontra, mais próximo do núcleo o elétron será adicionado, resultando em uma maior afinidade eletrônica.
O elemento com maior afinidade eletrônica na tabela periódica é o flúor. O flúor é um átomo pequeno do segundo período, que ao adicionarmos um elétron completa sua camada de valência.
Energia de ionização e afinidade eletrônica medem a capacidade de um átomo perder e ganhar um elétron, respectivamente, formando íons. Se um átomo possui elevada afinidade eletrônica, ele deve possuir baixa tendência a formar cátion (o que corresponde a um elevado valor de energia de ionização).
Tenha claro que a energia de ionização e a afinidade eletrônica estão relacionadas com a reatividade dos átomos em reações em que se doa e recebe elétrons.
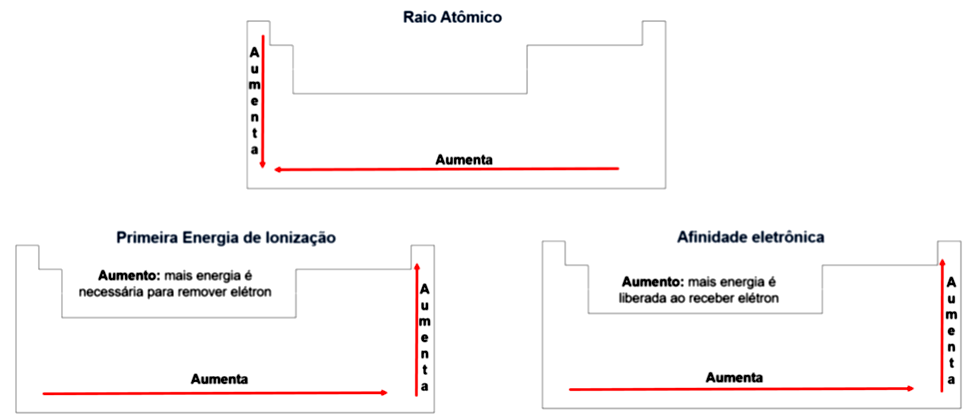
Em resumo, a variação das propriedades periódicas raio atômico, energia de ionização e afinidade eletrônica ocorrem de acordo com a Figura 1.7.
Vamos Exercitar?
Estudante, conhecer e compreender a tabela periódica e as propriedades periódicas da matéria auxilia na resolução de diferentes problemas relacionados as características dos elementos químicos.
Desse modo, para que você possa escolher qual elemento empregar como material para obtenção do transformador, você precisa lembrar que quanto menor for a energia de ionização, mais fácil é abstrair um elétron da camada de valência. Por isso é preciso conhecer como os valores de energia de ionização variam ao longo da tabela (Figura 1.8).
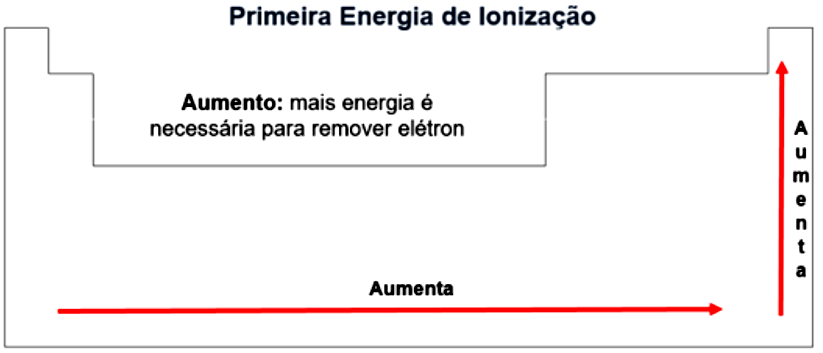
Com isso, fica evidente que quanto maior a energia de ionização, mais difícil abstrair um hidrogênio, você conclui, então, que os gases nobres e não metais não são boas opções, portanto, o elemento deve ser um metal.
A tendência seria escolher elementos dos grupos 1 e 2, entretanto, outros fatores devem ser levados em consideração, como a energia dos orbitais. Por isso, sua resposta fica restrita apenas a metais. Investigando quais metais são bons condutores, você observou que cobre é um excelente candidato, podendo ser uma boa proposta ao seu gestor.
Com isso, você conseguiu avaliar as propriedades periódicas para solucionar um problema de ordem química. Além disso, você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre a tabela periódica e a organização periódica dos elementos químicos, acesse a biblioteca virtual e faça a leitura do capítulo 2, Átomos, busque pelas seções destinadas ao estudo da tabela periódica, do livro “Introdução à química geral”, disponível na Minha Biblioteca.
BETTELHEIM, Frederick A.; BROWN, William H.; CAMPBELL, Mary K.; FARRELL, Shawn O. Introdução à química geral. São Paulo: Cengage Learning Brasil, 2016. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788522126354/. Acesso em: 25 jan. 2024.
Para compreender e aprofundar seus conhecimentos sobre a tabela periódica, faça a leitura do artigo: “Tabela periódica interativa: Um estimula à compreensão”, disponível em: https://doi.org/10.4025/actascitechnol.v23i0.2757. Acesso em: 25 jan. 2024.
Por fim, aprofunde seus conhecimentos sobre propriedades periódicas e sobre a periodicidade das propriedades químicas por meio da leitura e estudo do artigo “Propriedades periódicas dos elementos químicos e suas breves implicações em sistemas biológicos e nas ciências agrárias”, disponível em: https://doi.org/10.1590/SciELOPreprints.6148. Acesso em: 25 jan. 2024.
Referências Bibliográficas
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
KOTZ, J. C. et al. Química geral e reações químicas. 2. ed. São Paulo: Cengage Learning, 2014. v. 1.
Aula 3
Ligação e Estrutura Molecular
Ligação e Estrutura Molecular
Olá, estudante! Nesta videoaula você irá conhecer os princípios das ligações primárias, para isso, deve-se atentar para a regra do octeto, conhecer e saber representar a estrutura de Lewis e conhecer as ligações iônica, covalente e metálica. Esse conteúdo é importante para a sua prática profissional, pois esses conceitos guiam a formulação de compostos, otimizam processos industriais, e são essenciais em setores como química, farmacologia e engenharia, influenciando diretamente a concepção e produção de substâncias e materiais. Esteja preparado para embarcar nesta jornada de aprendizado! Vamos lá!
Ponto de Partida
Olá, estudante! Você já aprendeu que os átomos, constituintes de toda matéria, são compostos por núcleo e eletrosfera e que suas propriedades são definidas principalmente pela sua distribuição eletrônica. Como um bom observador, você notou que dificilmente a matéria é composta por um único tipo de átomo, mas, sim, pela combinação entre diferentes elementos. Nesta aula, você irá aprender como a distribuição eletrônica e as propriedades dos elementos determinam como os átomos serão conectados. Deste modo, reflita sobre como os elementos químicos originam as substâncias químicas e compostos?
Para isso, vamos imaginar que você está trabalhando em uma fábrica de insumos químicos aplicados à agricultura e seu gestor solicitou que você selecione solventes a serem aplicados em diferentes reações químicas, entre uma lista de três solventes: água, cicloexano e etanol. Ele disse a você que a água é um solvente polar, seguido em polaridade pelo etanol. Já o cicloexano é um solvente apolar. Sabendo que você estava no início do seu aprendizado em química, ele informou que sais (compostos iônicos) são bastante solúveis em água e que compostos polares dissolvem moléculas polares, assim como apolares dissolvem moléculas apolares. Para selecionar os solventes a serem empregados, você deve pegar a lista de compostos químicos e analisar quais as ligações envolvidas em cada molécula. Sua lista de reagentes continha: eteno (), cloreto de alumínio () e cloreto de metila (). Vamos começar nossa análise e escolher quais os solventes que atuam melhor na solubilização de cada molécula. Bons estudos!
Vamos Começar!
Em 1916, os químicos Gilbert N. Lewis (1875-1946) e Walter Kossel, independentemente, propuseram que a conexão dos átomos ocorria de modo que os elementos adquirem oito elétrons na camada de valência, o que equivale a dizer que eles assumem a configuração do gás nobre mais próximo (MAIA; BIANCHINI, 2007; KOTZ et al. 2014).
Para ambos, ligação química é a força atrativa entre dois átomos, resultante da reorganização dos elétrons de suas camadas de valência. Kossel propôs que átomos deveriam doar ou receber elétrons, enquanto a teoria de Lewis falava em compartilhamento de elétrons entre dois átomos. As duas situações são possíveis, a primeira hipótese forma as ligações iônicas, já o compartilhamento de elétrons caracteriza uma ligação covalente.
A camada de valência consiste na camada eletrônica mais externa. Os elétrons das outras camadas não estão envolvidos nas ligações químicas. Lewis desenvolveu uma notação para a camada de valência, em que o símbolo do elemento representa o número atômico e os elétrons internos das camadas eletrônicas, já a camada de valência é representada por pontos.
Ligação Iônica: neste tipo de ligação, os elétrons são transferidos de um átomo para outro. Com isso são formadas uma carga negativa no átomo que recebe elétrons e uma carga positiva no átomo que perde elétrons, sendo que a ligação química é a força de atração entre os íons positivo (cátion) e negativo (ânion). Um exemplo deste tipo de reação ocorre entre o sódio e o cloro, formando o composto iônico cloreto de sódio (Figura 1.9).
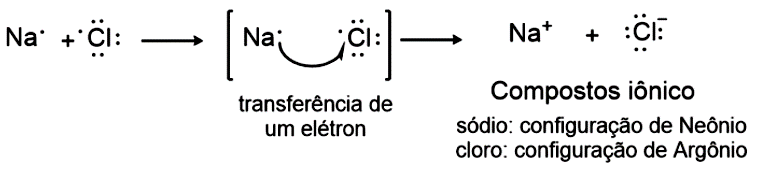
Você pode explicar esta reação com base nas propriedades periódicas estudadas na seção anterior: elementos do grupo 1 e 2 apresentam energias de ionização baixas (tendem a perder elétrons facilmente), enquanto elementos do grupo 6 e 7 têm elevadas afinidades eletrônicas (tendem a receber elétrons). Estas características explicam também a reação de cálcio e oxigênio, levando à formação do composto iônico óxido de cálcio ().
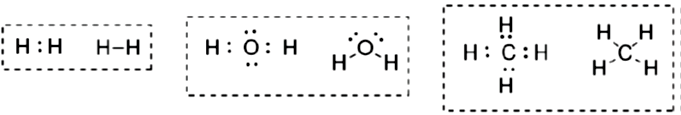
Ligação covalente: a ligação covalente se dá pelo compartilhamento de elétrons entre átomos, podendo ocorrer o compartilhamento de um ou mais pares de elétrons. Esta ligação ocorre na formação de compostos como , e
. A representação desta molécula ocorre utilizando estruturas de Lewis em que os pares de elétrons podem ser representados por traços (Figura 1.10).
Siga em Frente...
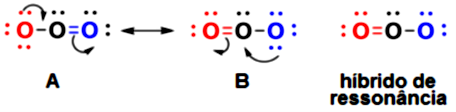
Para desenharmos estruturas de Lewis, devemos seguir a regra do octeto que consiste em deixar todos os átomos com configuração de gás nobre, ou seja, oito elétrons na camada de valência. Com exceção do H, Li e Be que tendem a ficar com dois elétrons, configuração do gás nobre He. Na construção da estrutura de Lewis do , você observou que C e O compartilham dois pares de elétrons, formando uma ligação dupla. Em algumas estruturas como o HCN, carbono e nitrogênio compartilham três pares de elétrons, formando uma ligação tripla. Para o gás ozônio () existem duas possibilidades de estruturas de Lewis, A e B, que se interconvertem (Figura 1.11). As duas estruturas são equivalentes, entretanto, nenhuma delas representa corretamente a molécula de ozônio que possui ligações O-O apenas de um tamanho, intermediário à ligação simples e dupla. A estrutura correta que representa esta molécula é um híbrido entre as duas estruturas, chamado híbrido de ressonância. A interconversão entre estruturas equivalentes é chamada de ressonância, note a seta que representa ressonância deve sempre ser ↔ .
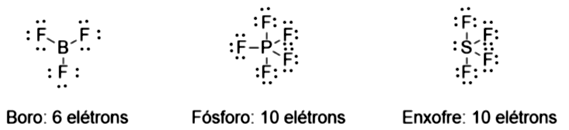
Embora a regra do octeto funcione a maioria das vezes, algumas moléculas atingem estabilidade com menos de oito elétrons na camada de valência, como o . Já moléculas contendo como átomo central elementos localizados a partir do terceiro período podem expandir a camada de valência, como ou
(Figura 1.12).
Embora até agora não tenhamos mencionado nada sobre ângulo entre as ligações em moléculas, estes ângulos podem variar, levando a diferentes geometrias moleculares. Um modelo que serve para prever a geometria de uma molécula é baseado na repulsão dos pares de elétrons das camadas de valência, em que a geometria depende do número de ligantes e também do número de pares de elétrons que não participam de ligações (isolados) no átomo central da molécula (Figura 1.13).
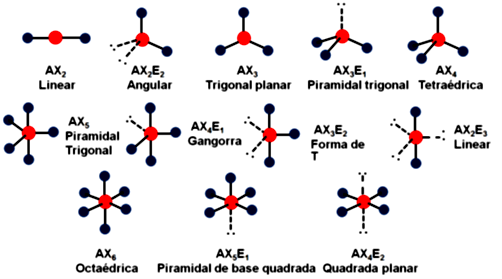
Até agora, vimos ligações covalentes como puras, ou seja, os átomos dividem igualmente o par de elétrons. Entretanto, isso é válido apenas quando temos dois átomos idênticos, como na molécula do gás cloro (Cl-Cl). Ligações como O-H presentes na água são ditas ligações covalentes polares, ou seja, um dos átomos atrai o par de elétrons com maior força. Átomos diferentes seguram seus elétrons da camada de valência com diferentes forças, ou aceitam elétrons extras com maior ou menor facilidade (energia de ionização e afinidade eletrônica), isso ocorre mesmo eles estando ligados.
Linus Pauling (1901-1994) propôs um parâmetro calculado a partir de Afinidade Eletrônica (AE) e Energia de Ionização (EI), capaz de prever a polarização da ligação, a eletronegatividade. Os valores de eletronegatividade são conhecidos e tabelados, podendo ser consultados. A eletronegatividade dos átomos é uma propriedade periódica, aumentando da direita para a esquerda na tabela periódica e diminuindo de cima para baixo.
Ligações como HF são altamente polarizadas, pois a eletronegatividade do F é a maior da tabela, 4,0, e H é 2,2. Quando a diferença de eletronegatividade é muito grande, ocorre a transferência total do par de elétrons, formando um composto iônico, como no caso do NaCl (valores de eletronegatividade Na = 0,9 e Cl = 3,2). Na Figura 1.14, vemos a diferença entre os tipos de ligações, note que como o átomo apresenta apenas uma carga parcial na ligação covalente polar e não total como na ligação iônica, o símbolo utilizado é ou para cargas parciais positivas ou negativas, respectivamente (KOTZ, 2014, p. 357).

Então, vimos que moléculas podem ser formadas por ligações covalentes e compostos iônicos por ligações iônicas. Como ocorre a ligação nos metais? Os compostos metálicos são bons condutores elétricos e térmicos, brilhosos e flexíveis. Características que não encaixam nem nas ligações covalentes nem nas ligações iônicas, em sua totalidade. Realmente, entre átomos metálicos temos outro tipo de ligações, as ligações metálicas.
Para você começar a entender a ligação metálica, precisa lembrar que elementos pertencentes aos metais possuem baixa energia de ionização, ou seja, eles perdem elétrons da camada de valência com facilidade. Agora, vamos analisar o elemento lítio, ele possui apenas um elétron na camada de valência e para atingir a estabilidade, precisa perder um elétron. Os elétrons da camada de valência do lítio têm liberdade de movimento, devido a sua baixa energia de ionização. Neste contexto, se tivermos diversos átomos de lítio, sendo que os elétrons estarão livres em torno dos átomos, formando um mar de elétrons.
A força da ligação metálica é maior em elementos que perdem mais elétrons com facilidade, como o alumínio que forma o cátion , pois há uma maior interação do cátion com os elétrons quando comparado com cátions de carga +1. Agora que você sabe o que é uma ligação metálica, podemos analisar um pouco algumas propriedades destes compostos. O fato dos elétrons estarem se movendo em torno dos cátions faz com que ao aplicarmos pressão não ocorra o mesmo efeito que em compostos iônicos, a repulsão. Com isso, os compostos metálicos são flexíveis e não quebradiços.
O mar de elétrons explica também a boa condutividade elétrica, pois independente do movimento dos elétrons, sempre haverá núcleos positivos em sua volta. Ao aquecermos um pedaço de metal, fornecemos energia para os elétrons, que aumentam sua energia cinética. Uma vez que existe mobilidade, estes elétrons transferem a energia a outros pontos, aquecendo todo o metal após algum tempo. Se analisarmos as propriedades periódicas de energia de ionização, ao compararmos átomos mais da direita da tabela periódica com átomos do grupo 1 e 2, as propriedades metálicas vão modificando, ou seja, compostos metálicos do grupo 1 e 2 tendem a ser mais maleáveis que compostos metálicos de cobre, por exemplo. Para unir propriedades de diferentes metais, ou ainda modular propriedades de interesse, utiliza-se a formação de ligas metálicas. Estas ligas nada mais são que uma mistura de dois ou mais metais, ou metais e não metais (sempre com a predominância de metais) em estado líquido, com posterior resfriamento. Um exemplo de liga bastante utilizado é o ouro 18 quilates, em que prata ou cobre são adicionados para deixar o ouro menos maleável, possibilitando sua aplicação na fabricação de joias.
Vamos Exercitar?
Estudante, após conhecer e compreender as características das ligações químicas, é importante realizar a interpretação e a aplicação destes conteúdos, que são fundamentais na química e necessários quando se realizam pesquisas visando obter novos produtos.
Deste modo, para escolher o melhor solvente em uma determinada aplicação química, precisamos inicialmente avaliar a eletronegatividade dos átomos envolvidos em cada molécula e determinar se as ligações são iônicas ou covalentes (Tabela 1.1).
Elemento | Eletronegatividade (c) |
Carbono (C) | 2,5 |
Hidrogênio (H) | 2,2 |
Alumínio (Al) | 1,6 |
Enxofre (S) | 2,6 |
Cloro (Cl) | 3,2 |
Tabela 1.1 Eletronegatividade de elementos selecionados. Fonte: Kotz et al. (2014, p. 357).
Analisando os valores de eletronegatividade, você observa que das moléculas mencionadas, apenas o alumínio e o cloro apresentam grande Dc, sendo este composto o único iônico da lista. O alumínio apresenta camada de valência contendo , já o cloro apresenta camada de valência . Como temos três átomos de cloro e um de alumínio, este perde três elétrons de sua camada de valência. Como seu gestor informou, compostos iônicos são solúveis em água.
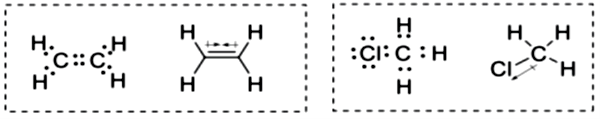
Os compostos e são moléculas contendo ligações covalentes. As diferenças entre as duas é que, a ligação C-Cl apresenta uma maior polaridade que C-H. Fazendo a estrutura de Lewis e consultando a geometria das moléculas, temos as estruturas descritas na Figura 1.15.
Com estes dados, observamos que devido ao eteno ser simétrico, ele é apolar. Já o clorometano é uma molécula polar. Com isso, para solubilizar estas moléculas devemos usar cicloexano e etanol, respectivamente. Você já se perguntou por que solventes polares dissolvem compostos polares?
Com isso, você conseguiu avaliar as solventes e verificar qual é a melhor opção para utilização em uma aplicação específica. Além dessa solução, você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre as ligações químicas, acesse a biblioteca virtual e faça a leitura do capítulo 3, Ligações Químicas, do livro “Introdução à química geral”, disponível na Minha Biblioteca.
BETTELHEIM, Frederick A.; BROWN, William H.; CAMPBELL, Mary K.; FARRELL, Shawn O. Introdução à química geral. São Paulo: Cengage Learning Brasil, 2016. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788522126354/. Acesso em: 25 jan. 2024.
Para compreender e aprofundar seus conhecimentos sobre a ligação química, faça a leitura do texto: “Ligações química: uma abordagem centrada no cotidiano”, disponível em: http://www.quimica.seed.pr.gov.br/arquivos/File/AIQ_2011/ligacoes_ufrgs.pdf. Acesso em: 25 jan. 2024.
Por fim, aprofunde seus conhecimentos sobre ligações iônicas e ligações covalentes, por meio da leitura do artigo “Ligações iônica e covalente: relações entre as concepções dos estudantes e dos livros de ciências”, disponível em: https://fep.if.usp.br/~profis/arquivos/vienpec/CR2/p676.pdf. Acesso em: 25 jan. 2024.
Referências Bibliográficas
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
KOTZ, J. C. et al. Química geral e reações químicas. 2. ed. São Paulo: Cengage Learning, 2014. v. 1.
MAIA, D. J.; BIANCHI, J. C. de A. Química geral e fundamentos. São Paulo: Pearson Prentice Hall, 2007.
Aula 4
Leis Ponderais
Leis Ponderais
Olá, estudante! Nesta videoaula você irá conhecer as Leis Ponderais, que se referem a princípios que descrevem as relações quantitativas entre as massas de reagentes e produtos em reações químicas. Entre elas temos a Lei de Conservação das Massas e a Leis das Proporções Constantes. Esse conteúdo é importante pois elas são fundamentais na química, possibilitando cálculos precisos em reações, essenciais para o controle industrial, síntese de substâncias e compreensão detalhada das relações quantitativas. Esteja pronto para embarcar nesta jornada de aprendizado! Vamos lá!!!
Ponto de Partida
Olá, estudante! A reação química é uma transformação que ocorre na matéria em que uma determinada substância, a qual damos o nome de reagente, é convertida em uma nova substância, chamada de produto. Para que uma reação química ocorra é necessário que determinadas condições estejam estabelecidas, uma delas são as quantidades de massa de cada reagente. Ao fim do século XVIII, Antoine Laurent Lavoisier e Joseph Louis Proust concluíram, com base em estudos experimentais, que as reações químicas seguem as chamadas Leis Ponderais e relacionam as massas dos reagentes e produtos participantes de uma reação química.
Pensando nesse fato, você já se deu conta de que itens básicos do seu cotidiano como, por exemplo, o seu celular, tablet, computador, fogão, geladeira, entre outros, somente existem porque reações químicas ocorreram para dar origem aos seus componentes e assim fabricar suas peças? Você já imaginou que existem proporções de massa relacionadas a essas reações?
Desse modo, vamos iniciar nossos estudos e conhecer as Leis Ponderais e suas aplicações, bem como as suas utilidades na produção de algumas substâncias bem conhecidas do nosso dia a dia, inclusive nos vidros que protegem e enfeitam os nossos lares e guardam nossos perfumes favoritos.
Para isso, vamos calcular a quantidade necessária de reagentes para produzir 500g de soda cáustica (NaOH) a partir dos princípios envolvidos na Lei de Conservação das Massas e avaliar a proporção entre os reagentes da reação química por meio da Lei das Proporções Constantes. Bons estudos!
Vamos Começar!
A Química tem como um de seus objetos de estudo as reações químicas. Segundo Zumdahl e DeCoste (2015), as reações químicas são na verdade rearranjos de agrupamentos de átomos que podem ser descritos por equações. Nas reações químicas, substâncias são consumidas e outras são formadas. As substâncias que são consumidas durante a reação química são chamadas de reagentes e as substâncias que se formam são chamadas de produtos.
As reações químicas foram bastante observadas ao longo do tempo e, no século XVIII, houve um grande avanço da Química como uma ciência bem fundamentada e os cientistas passaram a adotar o método científico em seus trabalhos. Por meio de estudos meticulosos e experiências cuidadosas, foram introduzidas leis importantes que conseguiram explicar como as reações químicas ocorriam e como as substâncias se comportavam com uma regularidade de modo geral. Entre essas leis estavam as Leis Ponderais, que eram aquelas que relacionavam as massas das substâncias participantes de uma reação química. Foram criadas três Leis Ponderais ao longo da história, sendo a Lei de Lavoisier, Lei de Proust e Lei de Dalton. Posteriormente foram criadas também as Leis Volumétricas de Gay-Lussac, que são utilizadas somente para substâncias em estado gasoso. Dentre as Leis Ponderais, existem duas mais importantes, que são: Lei de Lavoisier ou Lei da Conservação das Massas e Lei de Proust ou Lei das Proporções Constantes. Essas leis foram criadas, respectivamente, por Antoine Laurent de Lavoisier (1743-1794) e por Joseph Louis Proust (1754-1826).
Lei de Conservação das Massas
Em 1774, a Lei de Lavoisier ou Lei da Conservação das Massas foi estabelecida por Antoine Laurent de Lavoisier e diz que “em uma reação química feita em recipiente fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos”.
A lei foi fundamentada após realizado um experimento que envolvia a calcinação do mercúrio metálico em um recipiente fechado, chamado retorta, que teve uma de suas extremidades introduzida em uma redoma contendo ar e mercúrio e colocada sobre uma cuba de vidro com mercúrio. Ao fim da reação houve a produção de óxido de mercúrio II, pois o mercúrio reagiu com o oxigênio presente no ar formando o óxido de mercúrio II. Foi observado que a quantidade de mercúrio presente na redoma havia aumentado, ocupando o espaço do ar e consequentemente o volume inicial do ar foi reduzido.
Ao final do experimento, Lavoisier verificou que a massa no recipiente fechado não se alterou e, assim, concluiu que a massa produzida pelo metal foi compensada pela massa consumida pelo ar; o que significava que o oxigênio do ar havia reagido com o metal ou se combinado com ele. Assim, Lavoisier concluiu que em uma transformação química, pesando-se as massas dos reagentes e as massas das substâncias produzidas depois da transformação (produtos), verifica-se que a soma das massas dos reagentes é igual à soma das massas dos produtos, conforme a Equação a seguir,
(1)
sendo i o número de substâncias.
A Lei da Conservação das Massas ficou popularmente conhecida ao estabelecer que a matéria não pode ser criada, não pode ser destruída, apenas transformada. Nas reações químicas não apenas a massa das substâncias envolvidas se conserva, mas a massa dos elementos contidos nas substâncias também permanece constante. A Lei de Lavoisier tornou possível a análise quantitativa fundamental para o desenvolvimento da Química e o cálculo do rendimento das reações, que trouxe grande impulso ao desenvolvimento da química industrial. O uso das balanças nos laboratórios, já praticado anteriormente, tornou-se fundamental.
A seguir estão relacionados alguns exemplos da aplicação da Lei de Lavoisier
| Carbono | + | Oxigênio | à | Gás carbônico |
1º ensaio | 3g | + | 8g | = | 11g |
2º ensaio | 12g | + | 32g | = | 44g |
Siga em Frente...
Lei das Proporções Constantes
Em 1797, Joseph Louis Proust estabeleceu a Lei das Proporções Constantes, que foi enunciada como: “a proporção em massa das substâncias que reagem e que são produzidas numa reação é fixa, constante e invariável”. Foi verificado por Proust que as massas dos reagentes e produtos envolvidos em uma reação química seguem uma proporção constante. Esta proporção é uma característica própria de cada reação e não é dependente da quantidade das substâncias que são colocadas para reagir.
Por exemplo, seja C uma substância que se originou de uma reação tendo A e B como reagentes. Proust verificou que para a formação de C, a substância A sempre reage com a substância B em uma proporção constante e definida. Observou, também, que não importa a quantidade de massa dos elementos usada, a proporção sempre será a mesma e constatou que a lei se aplicava para qualquer reação química, conforme representado a seguir, sendo , e
as massas de A, B e C, respectivamente.
| A | + | B | à | C |
1º ensaio | + | = |
| ||
2º ensaio | + | = |
Assim, a Lei de Proust foi equacionada da seguinte forma, conforme Equação a seguir:
(2)
Portanto, para a reação ocorrida entre o hidrogênio e oxigênio formando água, os seguintes valores podem ser obtidos:
| Hidrogênio | + | Oxigênio | à | C |
1º ensaio | 10g | + | 80g | = | 90g |
2º ensaio | 2g | + | 16g | = | 18g |
3º ensaio | 1g | + | 8g | = | 9g |
4º ensaio | 0,4g | + | 3,2g | = | 3,6g |
Observa-se que para cada reação química, o somatório das massas dos produtos é igual ao somatório das massas dos reagentes, o que segue a Lei de Lavoisier, e as massas dos reagentes e dos produtos presentes nas reações não são iguais, mas as relações de massa são. Conforme o exemplo a seguir, em que as relações de massa de oxigênio/massa de hidrogênio, massa de água/massa de hidrogênio e massa de água/massa de oxigênio são sempre constantes.
| + | à | |||
1º ensaio | + | = | |||
2º ensaio | + | = | |||
3º ensaio | + | = | |||
4º ensaio | + | = |
Entre , , são sempre constantes.
Vale ressaltar que John Dalton desenvolveu a teoria sobre a estrutura atômica com base nas Leis de Lavoisier e Proust, que foram muito importantes para estudos posteriores. Os conceitos das Leis Ponderais auxiliam a prever as massas necessárias de reagentes e produtos em uma reação química, através de um cálculo, conhecido como cálculo estequiométrico.
Exemplificando
A produção do dióxido de carbono utiliza carbono e oxigênio como reagentes. Foram realizados três ensaios com essa reação e observou-se que a proporção entre o oxigênio e o carbono sempre será 2,66 conforme a Lei Ponderal de Proust. Foi observado também que essa reação obedece à Lei de Lavoisier, ou seja, a massa no sistema permanece constante. Com base nessas leis, avalie os respectivos valores das massas (em gramas) que substituiriam corretamente as letras A, B e C.
Nesses experimentos:
| C | + | à | ||
1º ensaio | A |
| 8g |
| 11g |
2º ensaio | 6g |
| B |
| 22g |
3º ensaio | 9g |
| 24g |
| Cg |
Assim temos:
| + |
| à | Proporção | ||
1º ensaio | 3g |
| 8g |
| 11g | |
2º ensaio | 6g |
| 16g |
| 22g | |
3º ensaio | 9g |
| 24g |
| 33g |
Vamos Exercitar?
Estudante, após conhecer e compreender dos processos que envolvem as massas de uma determinada reação química e a aplicação da Lei de Conservação das Massas e a Lei das Proporções Constantes, você precisa calcular a quantidade necessário de reagentes para produzir 500g de soda cáustica (NaOH) e avaliar a proporção entre os reagentes da reação química.
Desse modo, é preciso proceder os cálculos para determinar as quantidades envolvidas no processo.
| + | à | + | Proporção | ||||
1º passo | 106g | + | 74g | = | 80g | + | 100g | 0,70 |
2º passo | 180g |
| 180g |
| ||||
3º passo | 662,5g | + | 462,5g | = | 500g | + | 625g | 0,70 |
Desse modo, para produzir 500g de soda cáustica, é necessário 662,5g de carbonato de sódio, mas 462,5g de hidróxido de cálcio.
Com isso, você conseguiu aplicar os conceitos da Lei de Conservação das Massas para solucionar um problema do cotidiano relacionado a produção de uma quantidade definida de produto a partir de seus reagentes, considerando a massa de produto a ser obtido. Além dessa solução, você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre as leis ponderais e sobre as relações de massas envolvidas em reações químicas, acesse a biblioteca virtual e faça a leitura do capítulo 3, Relações de massas nas reações químicas, do livro “Química”, disponível na Minha Biblioteca.
CHANG, Raymond; GOLDSBY, Kenneth A. Química. Porto Alegre: Grupo A, 2013. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788580552560/. Acesso em: 25 jan. 2024.
Para compreender e aprofundar seus conhecimentos sobre a lei de conservação das massas, faça a leitura do artigo: “Lei da conservação das massas: experimentação e contextualização”, disponível em: https://pdf.blucher.com.br/chemistryproceedings/5erq4enq/eq26.pdf. Acesso em: 25 jan. 2024.
Por fim, aprofunde seus conhecimentos sobre a Lei de Proust, por meio da leitura do texto “Lei de Proust”, disponível em: https://acervodigital.unesp.br/bitstream/123456789/41532/7/2ed_qui_m4d8_tm01_box4.pdf. Acesso em: 25 jan. 2024.
Referências Bibliográficas
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
ZUMDAHL, Steven S.; DECOSTE, Donald J. Introdução à química: fundamentos. 8. ed. São Paulo: Cengage Learning, 2016.
Encerramento da Unidade
Introdução à Química e ao Universo Atômico e Molecular
Videoaula de Encerramento
Olá, estudante! Nesta videoaula você irá rever os conceitos sobre átomos e modelos atômicos, distribuição eletrônica, tabela periódica, propriedades periódicas, ligação química primária e leis ponderais. Esse conteúdo é importante para a sua prática profissional, pois esses fundamentos orientam decisões em setores como química, engenharia e saúde, impactando inovações, processos industriais e descobertas científicas. Esteja pronto para embarcar nesta jornada de aprendizado! Vamos lá!
Ponto de Chegada
Olá, estudante! Para desenvolver a competência desta Unidade, que é conhecer e compreender os princípios e fundamentos da química geral importantes para o desenvolvimento dos demais ramos da Química, você deverá primeiramente conhecer a área de estudo da química, que estuda a matéria e suas transformações. Desse modo, você precisa compreender como o modelo atual do átomo foi desenvolvido, quem foram os cientistas que desenharam o modelo atual e quais as implicações desse modelo no desenvolvimento da ciência, assim como suas aplicações. Dentro desse estudo você compreende as características dos números quânticos, que funcionam como um enderenço de um elétron na eletrosfera de um átomo, assim como realiza a distribuição eletrônica, fundamental para compreender os princípios relacionados as ligações químicas. Na sequência, você conhece e compreende a tabela periódica, iniciando seu estudo na evolução da estruturação da tabela até o modelo atual, compreendendo as características de organização dos elementos químicos e sua classificação, além de estudar as propriedades periódicas, que são possíveis de serem previstas apenas pela posição do elemento na tabela. Na continuação, você começa o estudo das ligações químicas, verificando as condições iniciais para que se estabeleçam as ligações químicas e as condições para que um determinado tipo de ligação se estabeleça. Nesse sentido, temos o estudo da ligação iônica, ligação covalente que origina as moléculas, como as moléculas possuem uma quantidade de estruturas possíveis, temos o estudo das estruturas moleculares e como é feita a representação delas por meio da Estrutura de Lewis e a ligação metálica. Por fim, temos o estudo das leis ponderais. Quando temos uma reação química, precisamos determinar quais são os reagentes e produtos dela, assim como as relações de massa existentes entre reagentes e produtos. Desse modo, temos que a Lei de Conservação das massas relaciona a quantidade de matéria após uma transformação química e a Lei de Proust relaciona a uma proporção definida entre os reagentes e produtos que são formados por uma reação.
É Hora de Praticar!
Imagine que você é um trainee em uma empresa que fabrica células fotovoltaicas. Sua atribuição é acompanhar o processo de construção dessas células, desde a preparação das placas até a montagem final. Em suas primeiras semanas, um lote de células fotovoltaicas apresentou problema e foi devolvido. Seu gestor pediu que você investigasse qual o problema, verificando se as células tinham como serem reaproveitadas. As células fotovoltaicas são constituídas de materiais com características de semicondutores, como os que são utilizados em componentes eletrônicos. Os principais semicondutores produzidos pela sua empresa são silício com fósforo (P) e silício com boro (B). Você quer mostrar um bom desempenho ao seu gestor, sendo assim, nada melhor que entender a química envolvida neste processo.
Deste modo, você precisará solucionar alguns problemas.
- Um exemplo de células fotovoltaicas produzidas na empresa são as compostas por diodos, que consistem em duas placas, uma contendo elétrons livres e outra com espaço para receber elétrons, colocadas em contato. Porém, é preciso uma etapa extra para gerar a corrente elétrica, a luz solar. Como transformamos energia solar em corrente elétrica? Entendendo a estrutura atômica, você será capaz de entender a primeira parte deste processo. Seu segundo passo é estudar os elementos presentes nas células, fazendo sua distribuição eletrônica, sendo que dois dos principais produtos são os semicondutores Si-P e Si-B.
- Para aprender o processo de geração de corrente elétrica a partir da energia solar. Você começou a estudar os elementos Si, P e B. Você se perguntou por que o silício precisa ser dopado? O silício é um material classificado como semicondutor, por isso a passagem de elétrons por ele é facilitada com sistemas como o explicado para a célula fotovoltaicas. Para construir o material semicondutor, é necessário conhecer as propriedades dos átomos envolvidos no processo. Deste modo, como a reatividade está relacionada com a camada de valência e com propriedades como a energia de ionização e a afinidade eletrônica. Para continuar seus estudos sobre a célula fotovoltaica dos materiais envolvidos no processo, você deve comparar algumas propriedades dos átomos e conhecer suas camadas de valência dos átomos.
- Até o momento você entendeu o funcionamento básico de uma célula e compreendeu que a luz solar é responsável por gerar corrente elétrica no processo de excitação de elétrons e que não são os átomos de B e P elementares que dão as características necessárias para a célula fotovoltaica, devido a suas energias de ionização e afinidades eletrônicas. Então, você precisa pensar em termos de ligações químicas. O que são ligações químicas? Como fica o silício e os átomos de fósforo e de boro? Eles estão conectados? Você precisa entender estes materiais e, enfim, compreender os fundamentos químicos envolvidos no funcionamento desta forma limpa de geração de energia, podendo, assim, analisar o lote problemático e propor uma solução.
Reflita
Como podemos utilizar a estrutura atômica, números quânticos e distribuição eletrônica para realizar uma pesquisa de desenvolvimento de novos produtos?
Como a tabela periódica e as propriedades periódicas auxiliam na compreensão das ligações que se estabelecem entre os átomos para formar as substâncias químicas?
Em um sistema fechado, como se relaciona a massa dos reagentes e produtos? Como que podemos empregar essas informações para maximizar o rendimento das reações químicas e evitar os desperdícios?
Resolução do estudo de caso
Como trainee de uma empresa que fabrica células fotovoltaicas, você precisa identificar o problema de um lote defeituoso. A célula fotovoltaica produzida na empresa que você trabalha consiste em dispositivo composto por duas camadas, uma contendo um semicondutor dopado com fósforo e outra dopada com boro. Para gerar energia elétrica, é preciso a luz do sol. O sol é uma fonte de fótons, que faz com que elétrons do silício sejam promovidos para níveis mais externos até serem ejetados, como no efeito fotoelétrico.
Neste caso da célula fotovoltaica, os elétrons do silício da camada negativa (N) são excitados e ao serem ejetados colidem com os elétrons já existentes na camada. Isso resulta em um fluxo de elétrons.
Você deve fazer a distribuição eletrônica dos elementos silício (), fósforo () e boro (). O boro possui número atômico 5, portanto, possui 5 prótons e 5 elétrons em estado fundamental. Seguindo o diagrama de distribuição eletrônica temos B ⇒ , Si ⇒ e P ⇒ . Você precisará destas distribuições para seguir sua análise do material.
Para encontrar o problema no lote de células defeituosas, você começou a investigar o funcionamento de células fotovoltaicas, estudando os elementos Si, P e B. Ao olhar o silício na tabela periódica, observamos que ele é um elemento do 30 período e do grupo 14. Portanto, ele possui três camadas de elétrons e sua camada de valência tem quatro elétrons, com os orbitais 3p vazios. A camada de valência é a mais externa, portanto, . Sabendo que os orbitais p comportam seis elétrons, ainda faltam quatro para completar esta camada de valência.
O boro está no 2o período da tabela periódica, possuindo então duas camadas. Estando no grupo 13, possui três elétrons na camada de valência, . Para completar a camada de valência faltam cinco elétrons. O fósforo está no 3o período da tabela periódica, possuindo então três camadas. Estando no grupo 15, possui cinco elétrons na camada de valência, , faltando três elétrons para completar os orbitais p.
Quando você consulta as tabelas dos livros didático, observa que os valores de afinidade eletrônica são de , e , respectivamente, para boro, fósforo e silício. Embora o boro possua menos camadas (elétron adicionado mais próximo ao núcleo), silício e fósforo possuem maior número atômico, exercendo maior atração do núcleo com o elétron adicionado. Você deve achar que este critério está errado ao analisarmos fósforo e silício, mas pela camada de valência, observe que ao adicionarmos um elétron no fósforo, ele deve ocupar um orbital p que já contém um elétron. Enquanto, no silício, um elétron será adicionado a um orbital p vazio.
Com relação à energia de ionização, temos para o boro ; para o silício e para o fósforo . Podemos analisar que boro e silício possuem energias de ionização semelhantes, porém é muito mais difícil remover um elétron do fósforo, sendo necessária mais energia. O silício, o boro e fósforo não têm uma grande tendência a doar ou receber elétrons, portanto, eles não estão na forma de íons.
Por fim, você precisa entender por que uma placa possui átomos de silícios e fósforo, quanto outra possui átomos de silício e boro. As placas de silício, sem nenhum outro elemento, são átomos de silício conectados entre si por ligações covalentes simples. Como os átomos estão conectados? Temos o boro e o fósforo ligados ao silício, então sabemos que não é ligação metálica, pois não ocorre entre metais. As eletronegatividades dos elementos são: B ; P e Si . Observe que como a Dc (entre silício e os outros dois elementos) não é grande, não temos ligações iônicas, estando o silício ligado ao P e ao B por ligações covalentes.
O silício possui camada de valência , tendo quatro orbitais vazios, podendo realizar quatro ligações. Logo, temos um átomo de silício ligado a outros quatro. Quando substituímos um átomo de silício por fósforo, temos uma ligação silício-fósforo. O fósforo apresenta camada de valência , podendo realizar três ligações, porém, por estar no 30 período, o fósforo pode expandir sua camada de valência e receber quatro elétrons. Ao substituirmos um átomo de silício por um fósforo, temos o fósforo com um elétron excedente. Com relação ao boro, vimos que ele foge à regra do octeto por permanecer estável mesmo com um orbital vazio. Ao substituirmos um átomo de silício por um átomo de boro no cristal, teremos orbitais vagos para receber elétrons. Para ocorrer o funcionamento da célula, a placa contendo elétrons livres deve ficar voltada para o sol, para que o processo de excitação de elétrons movimente e faça com que ocorra o fluxo para a placa que possui a capacidade de receber elétron. A placa contendo Si-P possui elétrons livres e que a placa Si-B recebe elétrons. Com estas informações, você foi até a linha de produção e evidenciou que no dia de fabricação do lote não funcional de células, ocorreu a troca de placas contendo Si-P por placas de silício apenas, que não possuem características suficientes para tornar a célula efetiva. Bastou, então, trocar uma parte das células do lote em destaque para que nem todo o trabalho fosse perdido. Você solucionou o problema!
Dê o play!
Assimile
Estudante, a Química Geral nos proporciona uma visão abrangente e fundamental do universo atômico e molecular que nos cerca. Esta ciência explora a composição, estrutura, propriedades e transformações da matéria, fornecendo as bases para compreendermos os fenômenos químicos presentes em nosso cotidiano. A periodicidade das propriedades químicas, elucidada pela Tabela Periódica, revela padrões sistemáticos que orientam nossa compreensão das relações entre os elementos. Ao mergulharmos na intricada rede de ligações e estruturas moleculares, compreendemos como os átomos se unem para formar substâncias complexas. Além disso, as leis ponderais estabelecem princípios cruciais para quantificar as transformações químicas. Em conjunto, esses tópicos formam a base essencial para explorar os segredos da química e desvendar as leis que governam as interações entre átomos e moléculas.
Referências
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora Educacional S. A., 2016.
KOTZ, J. C. et al. Química geral e reações químicas.2. ed. v. 1. São Paulo: Cengage Learning, 2014.
MAIA, D. J.; BIANCHI, J. C. de A. Química geral e fundamentos. São Paulo: Pearson Prentice Hall, 2007.
ZUMDAHL, Steven S.; DECOSTE, Donald J. Introdução à química: fundamentos. 8. ed. São Paulo: Cengage Learning, 2016.