Estrutura atômica
Aula 1
O átomo
O átomo
Olá, estudante! Nesta videoaula serão abordados os conceitos relacionados à unidade básica da matéria, ou seja, o átomo. Assim, será possível compreender qual é a sua constituição fundamental, como está organizado no espaço, o motivo pelo qual há uma variedade de tipos atômicos e como a energia está a ele associada.
Tais conceitos e definições relacionados ao átomo e distribuições energéticas são essenciais para o desenvolvimento científico e tecnológico, aplicado em todas as áreas do conhecimento, pelo fato de que tudo que possui massa e ocupa um lugar no espaço é constituído por átomos. Assim, conhecê-lo e entender as possíveis relações que possam ter na constituição da matéria é fundamental para o desenvolvimento de sua prática pessoal.
Prepare-se, pois, para esta jornada de conhecimento! Vamos lá!
Ponto de Partida
Olá, estudante! Boas-vindas à disciplina de Química e Ciência dos Materiais, a qual tem por objetivo abordar os conceitos relacionados ao estudo de materiais, conhecendo suas principais propriedades, características e aplicações voltadas ao desenvolvimento de projetos de engenharia. Mas por que a Química é importante para análise dos materiais? A Química estuda a unidade básica da matéria, o átomo, e suas relações para a formação de moléculas, substâncias e materiais. Por essa razão, ela é tão importantes para a área.
Logo, nesta primeira aula, investigaremos o átomo, estudando sua composição, ordenação no espaço e distribuição energética. Do mesmo modo, exploraremos os conceitos fundamentais para compreensão da constituição e formação dos materiais, bem como a análise das propriedades mecânicas devido aos tipos de átomos e ligação entre eles.
Como aplicação de tais conceitos, imagine que você atua como trainee em uma grande empresa de desenvolvimento tecnológico de sua cidade, empresa essa que tem ganhado espaço no mercado nacional devido a seus projetos inovadores, considerando o melhor custo-benefício, propondo utilização de novos materiais.
Você foi solicitado para compor a equipe em um novo projeto que visava desenvolver um produto altamente resistente, mas que pudesse ser moldado facilmente a uma aplicação específica. Na primeira etapa, você ficou responsável por realizar um estudo sobre a estrutura da matéria, descrevendo a composição fundamental do átomo através do modelo atômico e apresentando a camada de valência de alguns elementos químicos através de sua distribuição energética. Os elementos escolhidos para esse estudo foram: alumínio, carbono, cobre, ferro e oxigênio.
Ao final dessa etapa, um relatório deve ser entregue ao coordenador do projeto contendo as informações por ele solicitadas.
Conhecer a constituição fundamental dos elementos químicos que compõem uma estrutura, um material ou molécula é fundamental para identificar as propriedades que estão presentes, sendo possível buscar alternativas de melhora de suas características, propondo a substituição e utilização de novos elementos químicos que se adaptem à estrutura inicial devido às particularidades que possuem.
Vamos conhecer os conceitos necessários para resolução do problema proposto?
Bom estudo!
Vamos Começar!
Conceitos fundamentais
Na física, matéria é definida como aquilo que possui massa e ocupa lugar no espaço. E tudo o que possui massa é constituído por átomos. A palavra átomo tem origem grega e significa “indivisível”. O átomo é considerado a menor parcela de divisão de um elemento/material sem que ocorra a perda das propriedades químicas; por essa razão, também é conhecido como unidade básica da matéria.
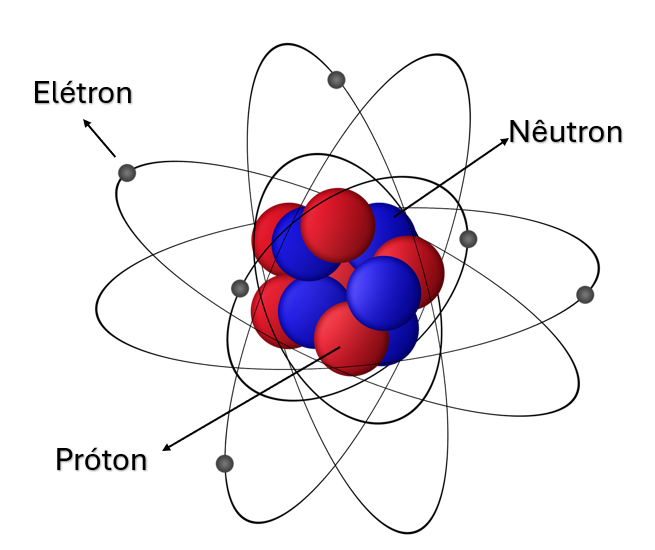
De maneira geral, o átomo é composto por um núcleo denso e muito pequeno, formado por nêutrons e prótons, envolvido por elétrons em movimentos orbitais. Tanto prótons quanto elétrons possuem cargas elétricas positivas e negativas, respectivamente, com o mesmo valor de 1,60x 10-19C. Já os nêutrons, como o próprio nome sugere, são eletricamente neutros. Essa configuração é possível devido à atração eletrostática entre prótons e elétrons no interior dos átomos, por possuírem cargas elétricas opostas que se atraem. Por fim, a massa de cada uma dessas partículas é infinitamente pequena: prótons e nêutrons com massa da ordem de 1,67x 10-27kg e elétrons com massa da ordem de 9,11x 10-31kg.
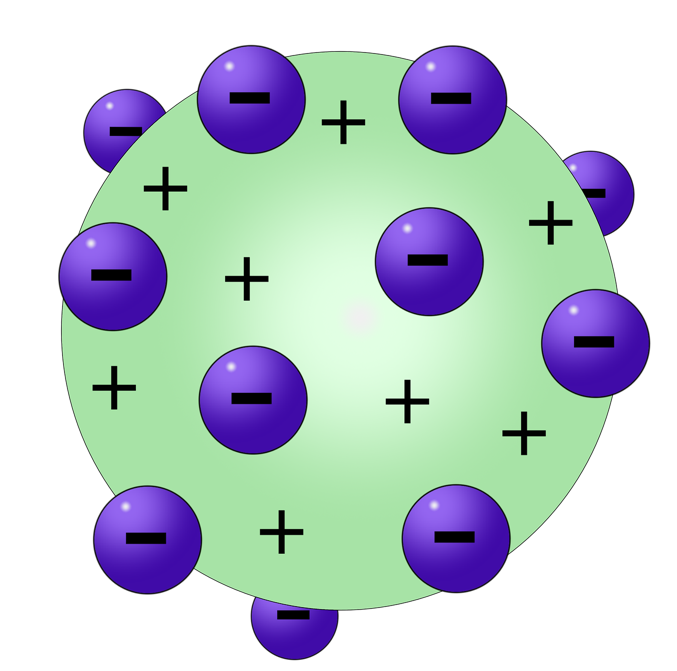
Cada elemento químico existente é caracterizado pela quantidade de prótons que se encontram em seu núcleo. Esse valor é conhecido como número atômico (Z). Por exemplo, o átomo de oxigênio apresenta 8 prótons em seu núcleo, assim, seu número atômico é igual a 8 (Z0 = 8). E ainda, para um átomo completo, ou seja, eletricamente neutro, o número atômico é igual ao número de elétrons que possui. A Figura 1 traz uma configuração esquemática da composição do átomo de carbono, com Z = 6.
Outra definição importante é a de massa atômica (A), que expressa a soma das massas dos prótons e nêutrons que constituem o núcleo atômico. O número de prótons sempre será o mesmo para todos os átomos de um mesmo elemento, mas o número de nêutrons (N) pode variar. Nesse caso, os átomos de alguns elementos químicos podem apresentar massas atômicas diferentes, recebendo o nome de isótopos. Assim, podemos relacionar a massa atômica (A) com o número de prótons (Z) e nêutrons (N) na Equação 1.
O hidrogênio é um bom exemplo para compreendermos o conceito de isótopo. Ele pode ser encontrado na natureza de três formas diferentes, variando sua massa atômica devido à quantidade de nêutrons em seu núcleo: prótio com apenas um próton no núcleo e a ausência total de nêutron; deutério que possui um próton e um nêutron no núcleo; e, por fim, o trítio com um próton e dois nêutrons no núcleo.
Já o peso atômico é obtido pela média ponderada das massas atômicas dos isótopos do átomo que ocorrem naturalmente. A unidade de massa atômica (uma) é utilizada para o cálculo do peso atômico e equivale a 1/12 da massa atômica do carbono 12, considerado o isótopo mais comum do carbono (C12).
O peso atômico pode ser expresso em termos de átomos ou moléculas, mas é comumente utilizado o conceito de massa por mol de material. Um mol, representado pelo número de Avogadro, contém 6,023 x 1023 átomos ou moléculas em uma substância. Assim, a Equação 2 expressa a relação entre as definições de peso atômico.
Por exemplo, em um mol de prata (Ag), com número atômico igual a 47, há 6,023 x 1023 átomos e 107,87 uma ou 107,87g. Ademais, com tais conceitos é possível calcular a quantidade de átomos e/ou moléculas em uma amostra de material. Esse cálculo é possível utilizando a massa atômica do átomo ou molécula e o número de Avogadro.
Exemplificando a ideia, podemos montar uma regra de três simples para calcular quantos átomos há em 100g de cobre (3).
Utilizando a tabela periódica, temos que a massa atômica desse elemento vale 63,55g. Substituindo os valores na Equação 3, a quantidade de átomos de cobre é dada por.
Importante ressaltar que esses conceitos fundamentais para compreensão do átomo, cálculo de massa atômica e número de Avogadro são importantes para o entendimento das estruturas e propriedades dos materiais.
Siga em Frente...
Modelo atômico e números quânticos
As fabulações iniciais sobre a constituição da matéria datam de muito antes da era cristã. Mas foi Demócrito (460 – 370 a.C.) que teorizou e nomeou o átomo por acreditar que a matéria chegaria em um ponto que não poderia mais ser dividida; em outras palavras, ele formulou teorias sobre a matéria ser formada por partículas indivisíveis, definindo-as como a menor unidade capaz de caracterizar um elemento químico e participar de uma reação química.
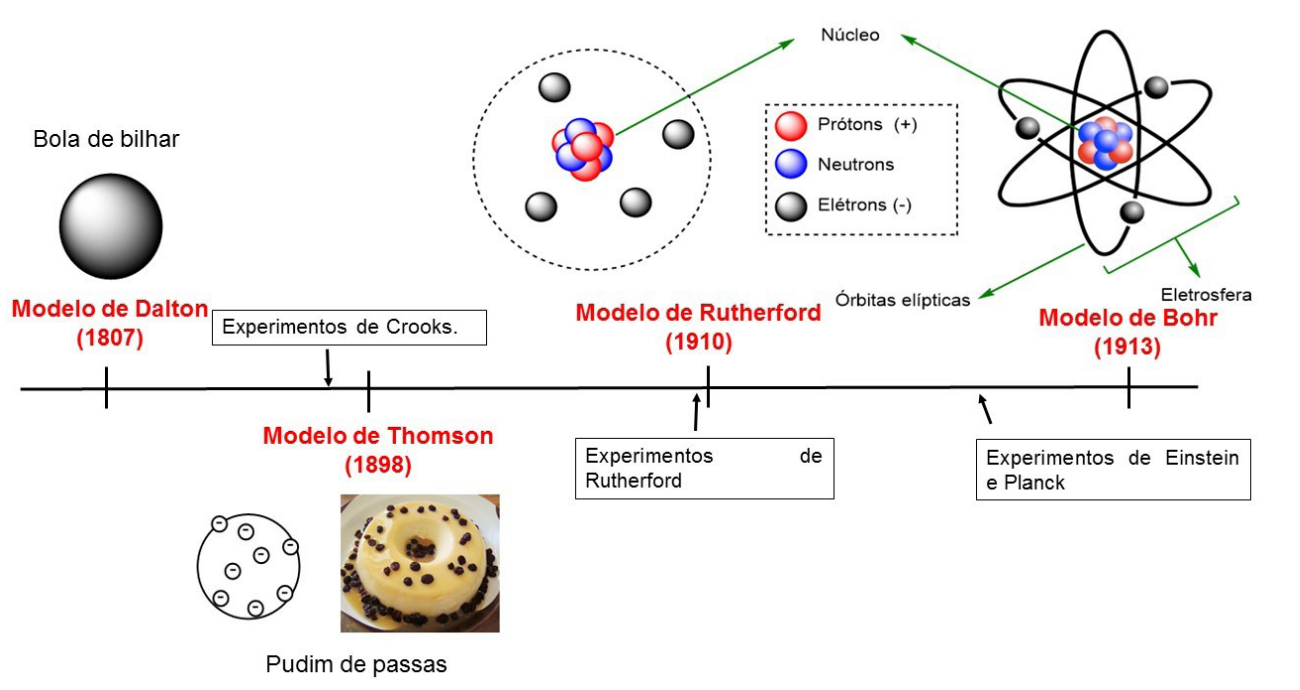
Esse pensamento perdurou por anos, até que em 1807, o cientista inglês John Dalton, ao realizar experimentos medindo a massa de diversos compostos, observou que a quantidade dos elementos permanecia sempre a mesma e confirmou a ideia de Demócrito sobre a indivisibilidade do átomo. Dalton associou o átimo a uma bola de bilhar: maciço e indivisível.
A partir de então, os estudos a respeito da constituição e estrutura da matéria foram despertando curiosidade. Tempo depois, houve a descoberta de partículas com carga elétrica no átomo gerando um outro modelo, conhecido como pudim de passas ou modelo de Thomson (1898). Em seus experimentos, o físico chegou à conclusão de que o átomo era formado por dois tipos de partículas, positivas e negativas, sendo que as partículas negativas estariam alocadas no interior do fluido positivo.
Com o passar dos anos, os estudos da radiação e suas partículas α (alfa), β (beta) e γ (gama) por Henri Becquerel (1896) e Marie e Pierre Currie (1898), permitiram que novos experimentos fossem realizados, levando a novas dúvidas sobre como seria o átomo.
Foi então que Ernest Rutherford (1910) propôs um novo modelo, sugerindo que o átomo seria composto por um núcleo denso e massivo contendo partículas positivas, rodeado por elétrons, que são espécies negativas. Contudo, considerando a interação eletrostática das cargas, algumas perguntas se tornariam inevitáveis, questionando a proposta do modelo:
- Como espécies carregadas positivamente não se repeliam no núcleo massivo e denso?
- Por que os elétrons não eram atraídos pelos prótons?
Como solução, Rutherford chegou à conclusão de que existiam outras espécies subatômicas localizadas no núcleo, sem carga, às quais chamou de nêutrons. Essa teoria foi confirmada em 1932 com a determinação de sua massa por James Chadwick.
Já a segunda pergunta era um pouco mais complexa. Foi então que em seus estudos, Niels Bohr e Arnold Sommerfeld (1913) propuseram a teoria de que os elétrons apresentavam movimento, percorrendo órbitas elípticas em torno do núcleo em camadas discretas de energia, conhecidas camadas eletrônicas.
No modelo proposto por Bohr, ao percorrer sua trajetória em um mesmo orbital, o elétron não emite energia. A absorção ou liberação desta ocorre apenas ao passar de uma camada à outra: absorção de energia quando o elétron passa de uma camada interna para uma mais externa e liberação de energia quando o elétron passa de uma camada externa para uma interna, sendo a quantidade de energia sempre múltiplo de uma quantia fixa, o chamado quantum.
O modelo atômico de Bohr foi a primeira tentativa de descrever o comportamento dos elétrons nos átomos considerando a posição e energia. Contudo, havia alguns questionamentos que esse modelo não conseguia explicar considerando o comportamento do elétron, principalmente com as descobertas de Louis de Broglie sobre o princípio da dualidade onda-partícula e de Heisenberg, com o princípio da incerteza. Finalmente, em 1926, Erwin Schroedinger propôs uma equação para calcular a máxima distribuição de probabilidades de se encontrar a posição de um elétron considerando quatro parâmetros, denominados números quânticos.
Esses números descrevem cada elétron levando em conta o seu estado, a distância a partir do núcleo, orientação espacial e o tipo de orbital mais provável. Eles são denominados por:
- Número quântico principal (n): indica o nível de energia do elétron, assumindo valores iguais a n = 1, 2, 3, 4, 5, 6 e 7. Essas camadas também podem ser denominadas por letras, sendo K (n = 1), L (n = 2), ...., Q (n = 7). Quanto maior o valor de n, mais distante o elétron estará do núcleo e maior será o tamanho do átomo e do orbital.
- Número quântico do momento angular (l): indica os subníveis do orbital; para cada valor de l haverá um subnível de energia específico s, p, d e f que está limitado ao valor do número quântico principal.
- Número quântico magnético (ml): indica a orientação do orbital no espaço, podendo assumir valores de -l a +l. Para o orbital s, ml = 0; p, ml = -1, 0, +1; d, ml = -2, -1, 0, +1, +2; e para f, ml = -3, -2, -1, 0, +1, +2, +3. Como exemplo, o orbital p apresenta 3 orientações: x, y e z (em um gráfico de coordenadas).
- Número quântico de spin (ms): indica o movimento do elétron ao longo do seu eixo. Apenas dois valores são possíveis, +1/2 e -1/2 , uma vez que o elétron pode girar apenas no sentido horário e anti-horário.
Configurações eletrônicas
Segundo o princípio da exclusão de Pauling, dois elétrons não podem apresentar o mesmo conjunto de números quânticos, ou seja, para cada orbital, é possível apenas dois elétrons. Por exemplo, se há dois elétrons com n = 3 (os dois na camada 3), l =1 (os dois no orbital p), ml = 0 (os dois com a mesma orientação espacial ou x, ou y, ou z) e cada um deles girando em um sentido .
Comumente, para estimar a posição de um elétron, é utilizado a representação de orbitais por caixas e de elétrons por setas, considerando a nomenclatura apresentada pela Figura 4 para indicação dos números quânticos.
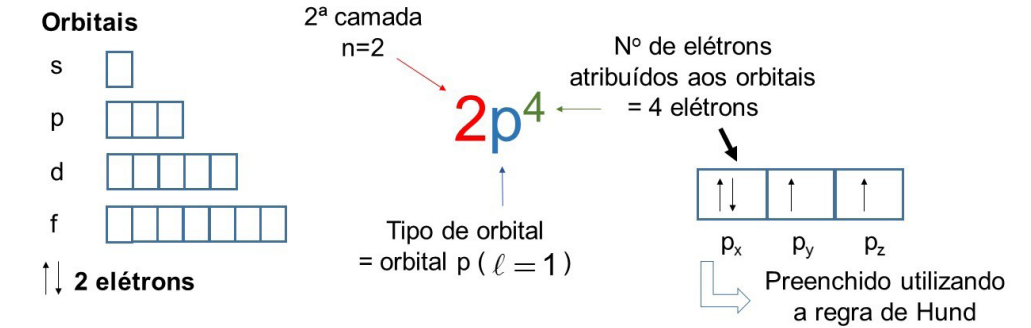
Na imagem, a descrição 2p4 indica que há quatro elétrons em orbitais p na camada 2, lembrando que as camadas internas possuem menor energia, o que também se aplica para os orbitais, pelo fato de que cada tipo possui diferente energia: s < p < d < f. Por definição, os orbitais de um mesmo tipo (como os três orbitais p: px,py e pz da Figura 4) são chamados de degenerados e o preenchimento deles ocorre seguindo a regra de Hund, distribuindo primeiro os elétrons com orientação +1/2 (representado por ↑), posteriormente os elétrons com orientação -1/2 (representado por ↓).
Os elétrons são distribuídos ao longo das camadas e subcamadas (estados eletrônicos) considerando o princípio da exclusão de Pauli, em que cada estado eletrônico comporta no máximo dois elétrons com spins opostos. Dessa maneira, os subníveis de energia s, p, d e f comportam, respectivamente, dois, seis, dez e quatorze elétrons. Esse processo é denominado distribuição eletrônica e deve ser utilizado colocando os primeiros elétrons na camada menos energética. A Tabela 1 apresenta as informações dos números quânticos e a representação gráfica dos orbitais para o desenvolvimento da distribuição eletrônica.
Subnível de energia | l | ml | Número de orbitais | Elétrons por subnível | Representação gráfica dos orbitais |
s | 0 | 0 | 1 | 2 | □ |
p | 1 | -1, 0, +1 | 3 | 6 | □□□ |
d | 2 | -2, -1, 0, +1, +2 | 5 | 10 | □□□□□ |
f | 3 | -3, -2, -1, 0, +1, +2, +3 | 7 | 14 | □□□□□□□ |
Tabela 1 | Descrição dos números quânticos e representação gráfica dos orbitais. Fonte: elaborada pela autora.
Segundo o princípio de exclusão, a distribuição eletrônica deve seguir os níveis de energia, indo dos de menor energia para os de maior energia, aplicando o mesmo conceito para os orbitais. Por exemplo: a primeira camada, n =1, possui apenas 1 orbital s. Já a segunda camada, n = 2, possui 1 orbital s e 3 orbitais p, sendo o orbital s menos energético que os orbitais p, preenchidos antes.
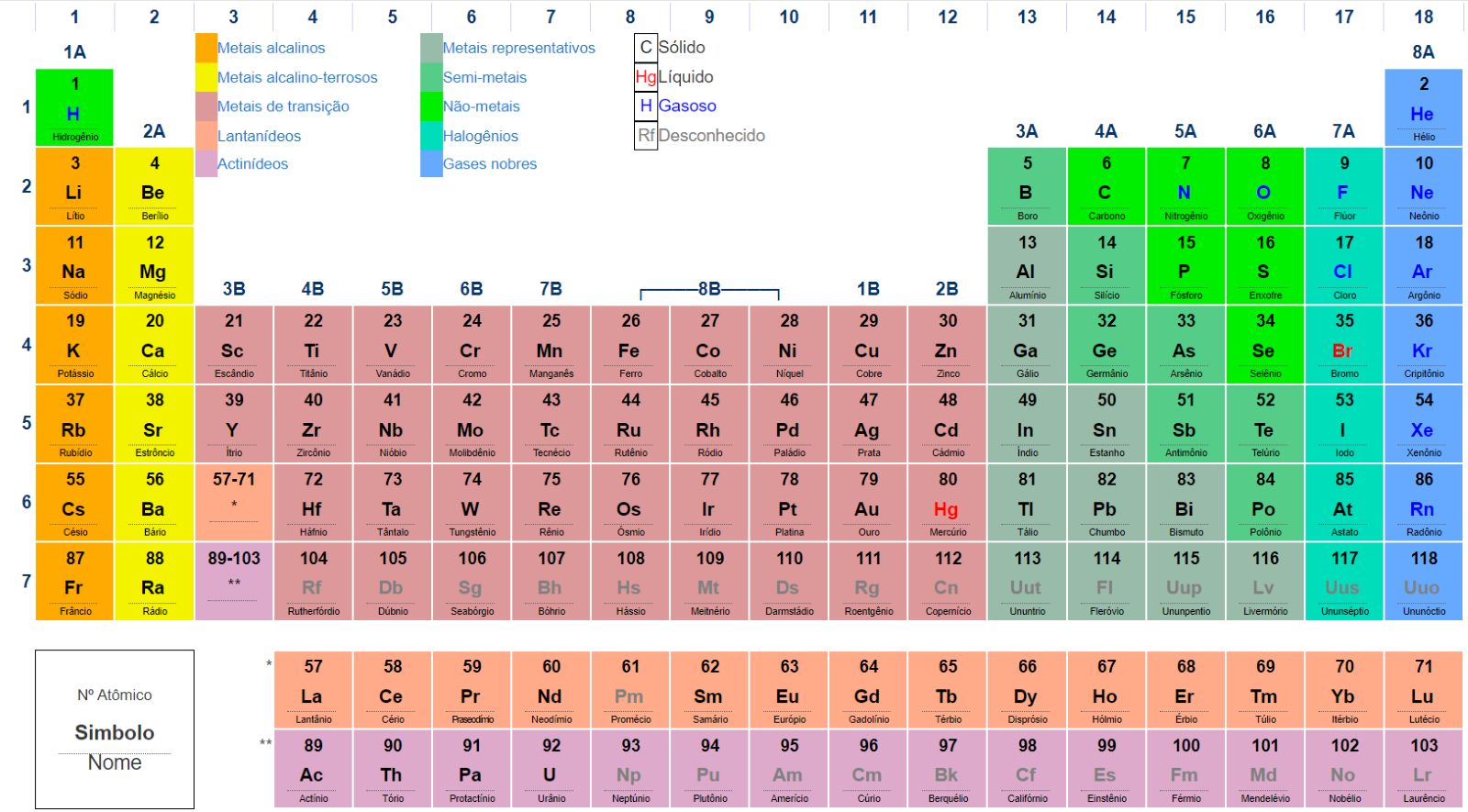
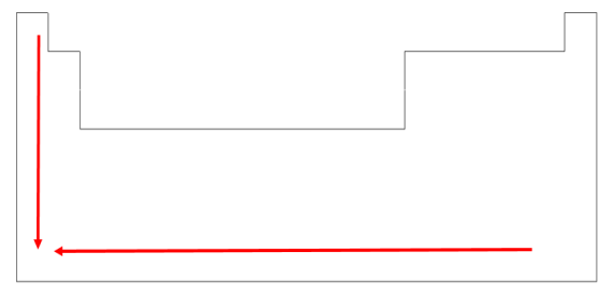
As energias das diferentes camadas e orbitais foram calculadas experimentalmente para definir qual orbital deve ser preenchido primeiro utilizando um diagrama conhecido como diagrama de distribuição eletrônica (Figura 5), que indica o sentido de preenchimento dos orbitais segundo os estados de crescimento de energia. Nesse diagrama, as camadas e subcamadas são completadas seguindo as setas vermelhas, iniciando por 1s, depois 2s, depois, 2p, 3s, seguido de 3p, 4s, entre outros.
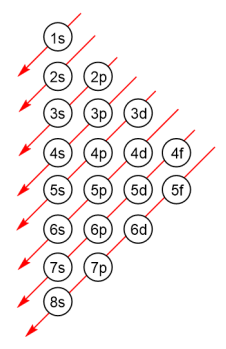
Vejamos um exemplo. O argônio (Ar) possui número atômico 18 (Z = 18), indicando que há 18 prótons em seu núcleo, sendo igual o número de elétrons, considerando o átomo neutro. Assim, pelo diagrama de distribuição de energia mostrado na Figura 5, sua configuração eletrônica será 1s22s22p63s23p6. Já o potássio (K) possui número atômico 19 (z = 19) e possui configuração eletrônica 1s22s22p63s23p64s1.
A última camada preenchida na distribuição eletrônica é conhecida como camada de valência, e os elétrons que estão alocados nela são denominados elétrons de valência. São justamente os elétrons de valência que participam das ligações químicas, formando agregados atômicos e moleculares. Além disso, muitas das propriedades físicas e químicas dos materiais tem como base os elétrons de valência.
Segundo o exemplo acima, para o argônio, a camada n = 3 é a camada de valência, com 8 elétrons de valência . Já para o potássio, a camada n = 4 é a camada de valência, com 1 elétron de valência .
Assim, podemos dizer que a representação da maneira como os elétrons estão distribuídos em níveis e subníveis de energia é denominada configuração eletrônica, utilizada para descrever os orbitais de um átomo no seu estado fundamental, isto é, quando os elétrons ocupam os níveis de menores energias possíveis. Logo, muitas propriedades físicas e químicas dos elementos estão correlacionadas com suas respectivas configurações eletrônicas. Os elétrons de valência, por exemplo, são os elétrons na camada (nível de energia) mais externa e o fator determinante de cada elemento químico ser único. A ordem crescente dos níveis de energia preenchidos pelos elétrons é igual a 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d,6p, 7s, utilizar o diagrama de energia de Pauling.
Vamos Exercitar?
Retomando o problema proposto inicialmente, será necessário realizar um estudo sobre a estrutura da matéria, descrevendo a composição fundamental do átomo através do modelo atômico e apresentando a camada de valência de alguns elementos químicos através de sua distribuição energética. Os elementos químicos que foram pedidos para esse estudo são: alumínio, carbono, cobre, ferro e oxigênio.
Para o desenvolvimento desta atividade, será preciso relembrar a composição fundamental do átomo: núcleo pequeno e denso, formado por prótons e nêutrons, envolvido por elétrons em movimento orbital. Cada elemento químico é caracterizado pelo número de prótons que possui em seu núcleo, denominado de número atômico (Z). E, para um elemento químico neutro, o número de prótons e elétrons são o mesmo.
Por fim, para obter a camada de valência dos elementos químicos propostos, bem como os elétrons de valência, os elétrons devem ser distribuídos ao longo das camadas e subcamadas considerando o princípio da exclusão de Pauli, em que cada estado eletrônico comporta, no máximo, dois elétrons com spins opostos. Assim, teremos:
- Alumínio (Z = 13): 1s22s22p63s23p1
- Carbono (Z = 6): 1s22s22p2
- Cobre (Z = 29): 1s22s22p63s23p63d104s1
- Ferro (Z = 26): 1s22s22p63s23p63d64s2
- Oxigênio (Z = 8): 1s22s22p4
Esses dados, então, podem ser agrupados e descritos no relatório que deverá ser entregue ao coordenador do projeto.
Tais informações e características dos átomos e elementos químicos são fundamentais para análise da estrutura da matéria, principalmente por ser o alicerce fundamental para a compreensão das ligações químicas que formam substâncias e materiais. Através desses conceitos, é possível identificar propriedades e características dos materiais, verificando sua aplicabilidade segundo a necessidade proposta.
Saiba Mais
Olá, estudante!
Veja os conceitos na prática, através da execução dos experimentos nos simuladores propostos a seguir, na plataforma Phet:
Bons estudos!
Referências Bibliográficas
ASKELAND, D. R.; WRIGHT, W. J. Ciência e engenharia dos materiais. São Paulo: Cengage Learning Brasil, 2019. E-book. ISBN 9788522128129. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788522128129/. Acesso em: 2 mar. 2024.
ATKINS, P. Físico-Química: fundamentos. 6. ed. Rio de Janeiro: Grupo GEN, 2017. E-book. ISBN 9788521634577. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521634577/. Acesso em: 3 mar. 2024.
CALLISTER JR., W. D. Ciência e engenharia de materiais: uma introdução. Rio de Janeiro: Grupo GEN, 2020. E-book. ISBN 9788521637325. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521637325/. Acesso em: 2 mar. 2024.
DREKENER, R. L.; SIMÊNCIO, E. C. A. Química e ciência dos materiais. Londrina : Editora e Distribuidora Educacional S.A., 2019.
KOTZ, J. C. et al. Química geral e reações químicas. São Paulo: Cengage Learning Brasil, 2023. v. 1. E-book. ISBN 9786555584516. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9786555584516/. Acesso em: 3 mar. 2024.
NEWELL, J. Fundamentos da moderna engenharia e ciência dos materiais. Rio de Janeiro: Grupo GEN, 2010. E-book. ISBN 978-85-216-2490-5. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/978-85-216-2490-5/. Acesso em: 2 mar. 2024.
SMITH, W. F.; HASHEMI, J. Fundamentos de engenharia e ciência dos materiais. Porto Alegre: Grupo A, 2012. E-book. ISBN 9788580551150. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788580551150/. Acesso em: 2 mar. 2024.
Aula 2
Tabela Periódica
Tabela Periódica
Olá, estudante! Nesta videoaula, a Tabela periódica será apresentada considerando as características, classificação e principais propriedades periódicas. Os conceitos e definições relacionados a este tema são fundamentais para o desenvolvimento de sua prática pessoal em qualquer situação de trabalho que envolva materiais e suas aplicações. Isso porque conhecer os elementos químicos e suas propriedades periódicas permite propor novos materiais, com propriedades relevantes para aplicação requerida, utilizando compostos diferentes.
A Tabela Periódica é, portanto, um modelo de tabela que agrupa e ordena todos os elementos químicos conhecidos e suas propriedades em ordem crescente correspondente aos números atômicos de cada um.
Preparado para esta nova jornada?
Bons estudos!
Ponto de Partida
Olá, estudante! Desejamos boas-vindas à segunda aula.
Nessa aula, dissertaremos sobre uma das tabelas mais importantes na Ciência: a Tabela Periódica. Essa tabela contempla todos os elementos químicos de maneira ordenada e periódica, levando em consideração a distribuição de energia e as propriedades periódicas. Através dela, é possível identificar as características de um elemento químico e conhecê-lo em sua essência, ponto fundamental para qualquer aplicação na prática profissional de Química e Ciência dos Materiais. Por essa razão, nosso estudo se concentrará na Tabela Periódica, entendendo seu processo de construção e compreendendo as características e propriedades periódicas.
Para captar melhor os conceitos que serão apresentados, continuemos com problemática em que você atua como trainee em uma grande empresa de desenvolvimento tecnológico de sua cidade e está participando do projeto que tem por objetivo desenvolver um produto resistente e maleável. Na primeira etapa, você ficou responsável por realizar um estudo sobre a estrutura da matéria, descrevendo a composição fundamental do átomo através do modelo atômico, e apresentou a camada de valência do alumínio, carbono, cobre, ferro e oxigênio. Agora, foi solicitado a você que realizasse um estudo a respeito das características e propriedades periódicas desses mesmos elementos químicos.
Conhecer a Tabela Periódica, dominando a sua utilização, é uma ferramenta de grande valia para o cotidiano de um profissional da área de Química e de Materiais, o qual compreenderá algumas propriedades e características dos compostos e/ou materiais, levando em consideração os elementos químicos que o constituem, bem como suas propriedades periódicas, físicas, químicas e mecânicas em função do tipo de ligação química na formação dos materiais.
Como o assunto é de grande importância para a formação de um bom profissional da área, vamos conhecer os conceitos necessários para resolução do problema proposto?
Bons estudos!
Vamos Começar!
Introdução à Tabela Periódica
Até meados do século de XIX, com o desenvolvimento da Ciência, novas descobertas foram surgindo através de diversos estudos e experimentos, incluindo muitos dos elementos químicos que hoje conhecemos. Contudo, sem nenhum tipo de ordenação, era difícil o acesso às informações importantes que cada elemento trazia.
Em 1869, com a finalidade de ordená-los conforme a semelhança de suas propriedades físicas e químicas, o químico russo Mendeleyev organizou os elementos pelos seus números atômicos. Já com o modelo quântico do átomo proposto por Erwin Schroedinger, outras características passaram a ser consideradas, como a distribuição eletrônica, passando as linhas da tabela periódica a conterem um determinado número de átomos até que suas propriedades químicas e físicas começassem a se repetir.
A Figura 1 apresenta a Tabela Periódica completa, com 118 elementos ordenados pelo número atômico em linhas horizontais, chamadas períodos, e em colunas verticais, denominadas famílias ou grupos, de acordo com as semelhanças das suas propriedades, começando com 1 para o período que contém hidrogênio (H) e hélio (He). Segundo IUPAC (2011), a Tabela Periódica possui famílias numeradas de 1 a 18 e os elementos podem ser divididos em três categorias (metais, semimetais e não metais) e os gases nobres.
Utilizar a tabela periódica é, pois, de grande ajuda para obter as principais propriedades dos elementos químicos de forma rápida e fácil para qualquer finalidade. Na formação de materiais, compreender os elementos químicos existentes auxilia a identificar o tipo de ligação química predominante, resultando nas propriedades químicas e físicas que o material apresenta.
Características da Tabela Periódica
Atualmente, a Tabela Periódica é dividida em grupos de elementos químicos que apresentam características em comum, como os gases nobres, que são espécies não reativas (já que possuem camada de valência completa, ou seja, com 8 elétrons de valência).
Na Tabela Periódica, as colunas são chamadas de grupos (famílias) e denominadas por números; já as linhas são chamadas períodos, e definidas pelo aumento do número atômico. Por fim, a localização do elemento químico na tabela fornece várias informações sobre a distribuição eletrônica que possui.
Na família 1 (coluna 1A), estão agrupados os metais alcalinos. Os elementos do grupo 2 (coluna 2A) são conhecidos como alcalinos-terrosos. A coluna 13 (família 3A) é conhecida como a família do boro e os elementos deste grupo possuem caráter metálico menos intenso que os metais alcalinos terrosos. Contido, o boro é considerado um não metal, o que contrasta com os outros elementos do grupo, classificados como metais.
A família 14 (4A) é a família do carbono e a família do nitrogênio é a 15 (5A). Já a família 16 (6A) é conhecida como calcogênios e a família 17 (7A) é a família dos halogênios. Por fim, os gases nobres estão localizados na família 18 (8A) e recebem esse nome devido à sua quase não reatividade com outros elementos químicos.
Uma curiosidade dos elementos contidos nas famílias “A” é que sua distribuição eletrônica sempre coincidirá o número da família com o número do elétron de valência. Por exemplo, o lítio (Li) está contido na família 1A, número atômico 3 e distribuição eletrônica dada por 1s22s1, ou seja, 1 elétron de valência. Outro exemplo, o oxigênio (O) está contido na família 6A, número atômico 8 e distribuição eletrônica dada por 1s22s22p4, ou seja, 6 elétrons de valência.
Entre as famílias 1B e 8B estão os elementos de transição, denominados assim por possuírem o subnível d incompleto ou formarem cátions com o subnível d incompleto. As duas linhas na parte inferior da tabela acomodam os lantanídeos e os actinídeos, elementos que também são considerados metais de transição. Muitas vezes nos referimos aos lantanídeos como terras raras, usados em ímãs, telas de LCD, baterias de carros híbridos, no polimento de vidros, dentre outras aplicações.
É importante citar que a distribuição eletrônica dos elementos de transição apresenta como principal característica os subníveis d (transição externa) ou f (transição interna) como mais energéticos. Assim, o rutênio (Ru) está contido no grupo 8B da tabela periódica, número atômico 44 e distribuição eletrônica dada por 1s22s22p63s23p63d104s24p64d65s2. Utilizando o diagrama de Linus Pauling, levando em consideração os estados de energia, a distribuição eletrônica do rutênio termina em 4d6 (Figura 2), caracterizando-o como um elemento de transição externa.
Compreender as características de ordenamento dos elementos químicos na Tabela Periódica auxilia, portanto, na identificação das propriedades dos elementos de cada grupo ou período, tornando possível sua substituição em ligações químicas de propriedades periódicas semelhantes, dando origem a novos tipos de materiais e/ou estruturas.
Siga em Frente...
Classificação e propriedades periódicas
É possível obter e verificar algumas informações sobre os elementos químicos por meio da Tabela Periódica. Essa possibilidade existe pelo fato de que há algumas propriedades que se repetem de tempos em tempos, propriedades atômicas que possuem tendências periódicas. São elas: tamanho atômico, tamanho iônico, energia de ionização e afinidade eletrônica.
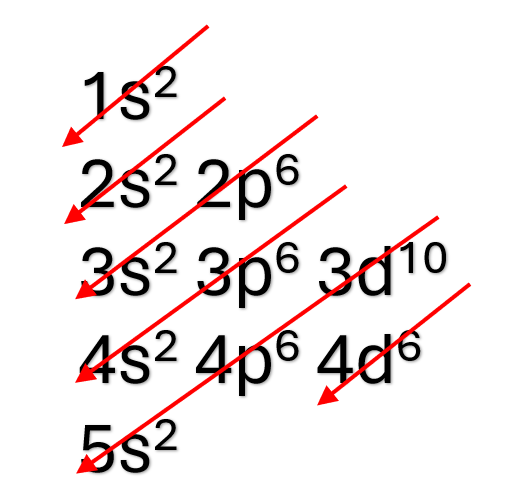
Seria possível afirmar qual é a fronteira de um átomo? Como poderíamos saber qual é o seu tamanho? Através da definição de orbitais, não há a possibilidade de traçar uma linha e dizer que o átomo chega até determinado ponto, nem matematicamente, nem com observações diretas. Porém, é possível utilizar medidas indiretas para conseguirmos os valores de tamanho atômico, como analisar moléculas compostas pelos mesmos átomos. Nessa abordagem, a utilização do raio atômico (ra) é fundamental, e sua definição é dada como metade da distância entre os centros de dois átomos.
Como exemplo, a Figura 3 apresenta os valores para o raio atômico do cloro (Cl) e carbono (C), através das moléculas de gás cloro (Cl2) e da grafita (C), respectivamente. Com estes dados, podemos prever o tamanho da ligação C – Cl, entretanto, temos que levar em conta que outros átomos próximos podem afetar esse tamanho de ligação.
Analisando os diferentes raios atômicos, observa-se que, à medida que os níveis de energia (n) aumentam, aumenta também o raio atômico. Assim, quanto maior o valor de n, maior o número de camadas. Dessa forma, o tamanho do átomo amenta de cima para baixo na tabela periódica. Ademais, o tamanho do átomo diminui com o aumento do número atômico (Z), pois à medida que ocorre o aumento em um próton, a atração com a eletrosfera é maior, o núcleo passa a atrair os elétrons mais fortemente, diminuindo o raio à proporção que aumenta o número atômico em um mesmo período. A Figura 4 traz uma representação da ordem de crescimento do raio atômico nos elementos que compõem a Tabela Periódica. Basicamente, o raio atômico aumenta de cima para baixo, da direita para a esquerda.
Tamanho iônico
Por definição, um íon é conhecido por um átomo que perdeu (cátion – carga positiva) ou ganhou elétrons (ânion – carga negativa). A distribuição eletrônica para os íons leva em consideração a quantidade de elétrons que possuem. Por exemplo, o sódio (Na) estável apresenta Z = 11, e sua distribuição eletrônica é dada por 1s22s22p63s1, mas para o cátion desse elemento (Na+), teremos 1s22s22p6. Ganhar e/ou perder elétrons implica no tamanho atômico, por essa razão, o raio iônico (ri) apresenta valores diferentes do raio atômico (ra).
Energia de ionização (EI)
É a energia necessária para a remoção de um elétron da camada de valência de um átomo em estado gasoso, levando à formação de cátions. Elétrons de camadas mais internas são mais difíceis de serem removidos devido à sua proximidade com o núcleo, e quanto maior for o raio atômico, menor será esta energia necessária para a remoção da carga, já que estão mais afastados do núcleo. Por essa razão, a energia de ionização aumenta no sentido contrário do raio atômico, ou seja, de baixo para cima e da esquerda para a direita (Figura 5).
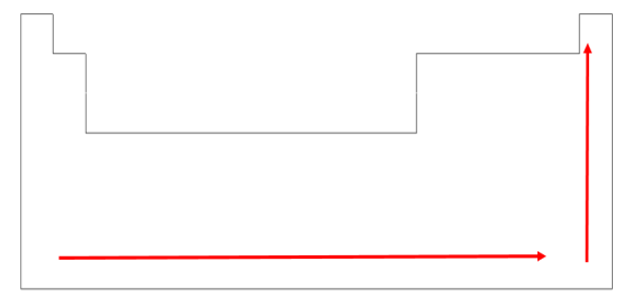
Afinidade eletrônica
A formação de ânions ocorre quando um átomo captura um elétron. A capacidade de um átomo capturar elétrons é avaliada como afinidade eletrônica quando o elemento está em fase gasosa. Comumente, quando ocorre a adição de um elétron a um átomo, ocorre a liberação de energia e, desta forma, quanto maior for a afinidade eletrônica, mais negativo será o seu valor. Quanto maior o número atômico ao longo do período, maior será a afinidade eletrônica. Seguindo a mesma linha de raciocínio, em um mesmo grupo, quanto mais acima o átomo se encontra, mais próximo do núcleo o elétron será adicionado, resultando em uma maior afinidade eletrônica. O elemento com maior afinidade eletrônica na tabela periódica é o flúor (F). Por essa razão, a afinidade eletrônica aumenta no sentido contrário do raio atômico, ou seja, de baixo para cima e da esquerda para a direita (Figura 6).
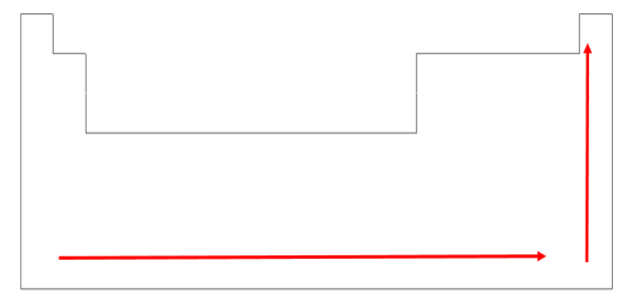
A energia de ionização e afinidade eletrônica medem a capacidade de um átomo perder e ganhar um elétron, respectivamente, formando íons. Se um átomo possui elevada afinidade eletrônica, ele deve possuir baixa tendência a formar cátion (o que corresponde a um elevado valor de energia de ionização). A energia de ionização e a afinidade eletrônica estão, pois, relacionadas com a reatividade dos átomos em reações em que se doa e recebe elétrons.
Mas não confundamos afinidade eletrônica com eletronegatividade! A eletronegatividade diz respeito à tendência de receber/capturar elétrons, e seus valores irão crescer no mesmo sentido da afinidade eletrônica, já que quanto menos elétrons um átomo necessita para garantir sua estabilidade, mais vontade deles ele terá.
Com os conhecimentos adquiridos até aqui, é possível compreender a representação atômica, bem como a maneira com a qual os elementos químicos estão organizados na Tabela Periódica e quais informações podemos extrair dessa organização, bem como prever ou interpretar tendências de propriedades de elementos e compostos.
Vamos Exercitar?
Retomando o problema proposto inicialmente, na etapa de desenvolvimento do projeto, foi solicitado a você que realizasse um estudo a respeito das características e propriedades periódicas elementos químicos alumínio, carbono, cobre, ferro e oxigênio.
Para a resolução desta atividade, será necessário consultar a Tabela Periódica para identificar as principais características de cada elemento, bem como suas propriedades periódicas. Dessa forma, teremos:
- Alumínio: é o elemento químico que pertence ao terceiro período e ao décimo terceiro grupo (família 3A) da Tabela Periódica. Seu símbolo é dado por Al, de número atômico 13 e massa atômica 26,982g. Segundo a sua localização na tabela, é um metal e apresenta 3 elétrons de valência, possuindo a tendência de doar elétrons em uma ligação química.
- Carbono: é um elemento químico do grupo 14 (família 4A) que pertence ao segundo período da Tabela Periódica. Devido à sua localização na tabela, é um elemento que possui 4 elétrons de valência, com tendência a receber ou compartilhar elétrons em uma ligação química. Seu símbolo é dado por C, de número atômico 6 e massa atômica 12g.
- Cobre: é um elemento químico do grupo 11 (família 1B) que pertence ao quarto período da Tabela Periódica. Devido à sua localização, é chamado de metal de transição e possui elétrons externo e subnível d completo. Seu símbolo é dado por Cu, de número atômico 29 e massa atômica 63,546g.
- Ferro: é um elemento químico do grupo 8 (família 8B) que pertence ao quarto período da Tabela Periódica. Devido à sua localização, é chamado de metal de transição e possui elétrons internos e subnível d incompleto. Seu símbolo é dado por Fe, de número atômico 26 e massa atômica 55,845g.
- Oxigênio: é um elemento químico do grupo 16 (família 6A) que pertence ao segundo período da Tabela Periódica. Devido à sua localização na tabela, é um elemento que possui 6 elétrons de valência, com tendencia em receber ou compartilhar elétrons em uma ligação química. Os elementos do grupo 16 são conhecidos como calcogênios, termo que advém da junção de duas palavras gregas, “Khalkos” (que significa cobre) e “genos” (que significa origem), ou seja, “originário do cobre”. Apesar do elemento químico cobre não fazer parte do grupo 16, ele assim é chamado pelo fato de que dois de seus elementos, o oxigênio e o enxofre, estão sempre presentes em minérios de cobre. Seu símbolo é dado por O, de número atômico 8 e massa atômica 16g.
Muitas outras informações podem ser obtidas sobre os elementos químicos citados, contudo, estas são as mais importantes em uma tabela periódica comum. Vale ressaltar que a Tabela Periódica é um modelo de tabela que agrupa e ordena todos os elementos químicos conhecidos e suas propriedades em ordem crescente correspondente aos números atômicos de cada elemento.
Saiba Mais
Olá, estudante!
Compreender os tipos de elementos químicos, suas principais características e como podem relacionar entre si é fundamental para a análise de propriedades dos materiais. Por essa razão, é importante ter o domínio sobre os conteúdos dispostos na Tabela Periódica para consultá-la quando necessário. Assim, saiba mais sobre os elementos químicos, seus períodos e famílias estudando as informações sobre a Tabela Periódica Completa e atualizada disponível no endereço a seguir.
- TABELA PERIÓDICA COMPLETA. A Tabela Periódica dos elementos químicos atualizada, 2024. Página inicial.
Bons estudos!
Referências Bibliográficas
ASKELAND, D. R.; WRIGHT, W. J. Ciência e engenharia dos materiais. São Paulo: Cengage Learning Brasil, 2019. E-book. ISBN 9788522128129. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788522128129/. Acesso em: 2 mar. 2024.
ATKINS, P. Físico-Química: fundamentos. 6. ed. Rio de Janeiro: Grupo GEN, 2017. E-book. ISBN 9788521634577. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521634577/. Acesso em: 3 mar. 2024.
CALLISTER JR., W. D. Ciência e engenharia de materiais: uma introdução. Rio de Janeiro: Grupo GEN, 2020. E-book. ISBN 9788521637325. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521637325/. Acesso em: 2 mar. 2024.
DREKENER, R. L.; SIMÊNCIO, E. C. A. Química e ciência dos materiais. Londrina : Editora e Distribuidora Educacional S.A., 2019.
KOTZ, J. C. et al. Química geral e reações químicas. São Paulo: Cengage Learning Brasil, 2023. v. 1. E-book. ISBN 9786555584516. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9786555584516/. Acesso em: 3 mar. 2024.
NEWELL, J. Fundamentos da moderna engenharia e ciência dos materiais. Rio de Janeiro: Grupo GEN, 2010. E-book. ISBN 978-85-216-2490-5. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/978-85-216-2490-5/. Acesso em: 2 mar. 2024.
SMITH, W. F.; HASHEMI, J. Fundamentos de engenharia e ciência dos materiais. Porto Alegre: Grupo A, 2012. E-book. ISBN 9788580551150. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788580551150/. Acesso em: 2 mar. 2024.
TABELA PERIÓDICA COMPLETA. A Tabela Periódica dos elementos químicos atualizada, 2024. Página inicial. Disponível em: https://www.tabelaperiodicacompleta.com. Acesso em: 3 mar. 2024.
Aula 3
Ligações químicas
Ligações químicas
Olá, estudante! Nesta videoaula, iremos compreender como os átomos e/ou íons se mantêm unidos nas estruturas químicas e formação de moléculas e materiais. Ou seja, abordaremos as ligações químicas primárias e secundárias.
Este tema é importante para o desenvolvimento de sua prática pessoal e profissional, pois as propriedades físicas e químicas dos materiais podem ser obtidas através do tipo de ligação química predominante no material. Além disso, caso seja necessária a alteração de algum elemento químico na construção do material, buscando melhoria nas propriedades desejadas, identificar a ligação química do composto inicial permite prever qual elemento químico pode ser utilizado nessa substituição, desenvolvendo materiais específicos para a aplicação desejada.
Chegou a hora de compreender as formas pelas quais os átomos podem ser ligados na constituição da matéria!
Vamos lá!
Ponto de Partida
Olá, estudante!
Nesta aula, investigaremos os tipos de ligações químicas e como os elétrons de valência estão envolvidos nesse processo. Dissertaremos sobre os três tipos de ligações químicas primárias, que ocorrem entre átomos, e as ligações de van der Waal, também conhecidas como ligações secundárias, que ocorrem entre moléculas.
As aplicações para esses conceitos são inúmeras, dentre elas, o fato de que permite selecionar materiais adequados para uma determinada aplicação segundo as propriedades requeridas.
Considerando tal temática, imagine que você atua como estagiário em um laboratório de pesquisa e desenvolvimento (P&D) que propõe projetos de inovação buscando substituir materiais comuns em aplicações usuais por novos materiais, com o foco nos avanços tecnológicos e visando melhor custo-benefício do projeto.
Pensando na importância na relação entre resistência mecânica e densidade dos materiais para os projetos em desenvolvimento, seu gestor solicitou que você realizasse uma pesquisa sobre a possibilidade de substituir os fios de cobre, utilizados na fiação elétrica de automóveis, por alumínio. Se houver essa possibilidade, quais características químicas serão relevantes para essa escolha? Ao final dessa etapa, um relatório deve ser entregue ao coordenador do projeto contendo as informações por ele solicitadas.
Com o estudo dos tipos de ligações químicas e das forças intermoleculares, será possível compreender o motivo pelo qual uma classe de materiais pode apresentar uma determinada característica ou propriedade em comum e, assim, selecionar o melhor material que atenda às vigências solicitadas.
Bons estudos!
Vamos Começar!
Íons e a ligação iônica
Tudo o que possui forma e ocupa lugar no espaço é constituído de átomos que são mantidos unidos por forças conhecidas por ligações interatômicas ou ligações químicas, conectando cada átomo a seu vizinho mais próximo. As diferentes propriedades dos materiais estão diretamente relacionadas aos tipos das ligações interatômicas. A grafita e o carbono, por exemplo, são constituídos essencialmente por carbono, mas exibem diferentes características em função da natureza da ligação química.
O conceito de ligação química foi proposto, simultânea e independentemente, por dois químicos, Gilbert N. Lewis (1875 – 1946) e Walter Kossel (1888 – 1956), em 1916. Eles afirmaram que a conexão dos átomos ocorria para que os elementos adquirissem estabilidade química, ou seja, o preenchimento completo da camada de valência, assumindo a configuração de gás nobre. Para ambos os cientistas, ligação química é a força atrativa entre dois átomos, resultante da reorganização dos elétrons de suas camadas de valência, até atingir oito elétrons.
De modo geral, as ligações químicas são classificadas em primárias e secundárias; contudo, algumas bibliografias as denominam ligações fortes e fracas, respectivamente. As ligações primárias ocorrem entre átomos e envolvem a doação ou o compartilhamento de elétrons para formar uma configuração eletrônica estável. Já as ligações secundárias ocorrem entre moléculas, ou seja, a atração de uma molécula qualquer com suas vizinhas.
Com o objetivo de facilitar a representação da camada de valência de um átomo para analisar a possibilidade de ligações químicas, Lewis desenvolveu uma notação para a camada de valência dos elementos químicos, em que apresenta o símbolo do elemento rodeado por pontos indicando a quantidade de elétrons de valência.
Por exemplo, o sódio (Na) possui Z = 11 e distribuição eletrônica 1s22s22p63s1, sendo a camada 3 a última camada preenchida, portanto, a camada de valência. Como a camada 3 é composta por 3s1, há apenas um elétron de valência. Assim, a representação de Lewis para o sódio será . Já para o oxigênio (O), com Z = 8 e configuração eletrônica 1s22s22p4, a camada de valência (n = 2) possuirá 6 elétrons (2s22p4) e sua representação de Lewis será
.
As ligações primárias são interatômicas e, por essa razão, são consideradas ligações químicas fortes. Dentre elas, as ligações iônicas, que ocorrem entre elementos metálicos e não metálicos, são caracterizadas pela transferência de elétrons de um átomo para o outro. Ou seja, o átomo que possui menos elétrons na camada de valência (metalicos) doa seus elétrons para o átomo que possui mais elétrons na camada de valência (não-metálicos) até que a estabilidade química seja alcançada. Nesse processo, os átomos que perdem e ganham elétrons se tornam íons, cátions (íons positivos) e ânions (íons negativos), respectivamente.
Um exemplo comum desse tipo de ligação é o composto cloreto de sódio (NaCl), mais conhecido como sal de cozinha. Para a formação desse composto, ocorre uma reação iônica entre o sódio (Na) e o cloro (Cl). O sódio, com 1 elétron na camada de valência, o doa para o cloro, inicialmente com 7 elétrons. Nesse processo, há a geração dos íons Na+ e Cl-, que são atraídos por meio da ligação química. Assim, ao final dessa transferência de elétrons originando os íons Na+ e Cl-, e a atração entre eles, a estabilidade química é alcançada e o composto formado. Esse processo é apresentado pela Figura 1.
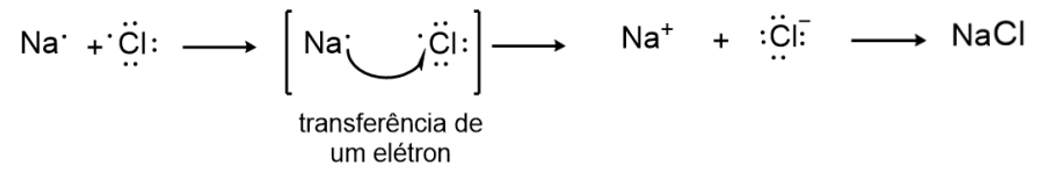
Para a geração de íons, os elementos químicos do grupo principal tendem a perder ou ganhar elétrons, buscando a estabilidade química por adquirir a configuração de gás nobre. Por definição, os íons oriundos de átomos que perdem elétrons são chamados cátions e representados pela carga positiva (+). Já os íons provenientes de átomos que ganham elétrons formam ânions, representados pela carga negativa (-).
Considerando as propriedades periódicas, os elementos químicos das famílias 1A, 2A e 3A apresentam energias de ionização baixas, com tendência a perder elétrons com facilidade, enquanto elementos químicos das famílias 5A, 6A e7A possuem elevadas afinidades eletrônicas, tendendo a receber elétrons.
Na ligação química do cloreto de sódio (NaCl), apenas um íon de cada elemento químico foi suficiente para a estabilidade química e formação de composto. Mas nem sempre será assim. Por exemplo, o composto alumina, também conhecido como óxido de alumínio, é formado por íons de alumínio e oxigênio. Nesse caso, para garantir a estabilidade química do composto, foram necessários dois átomos de alumínio e três de oxigênio. A Figura 2 apresenta o processo formativo para o composto alumina (Al2O3).
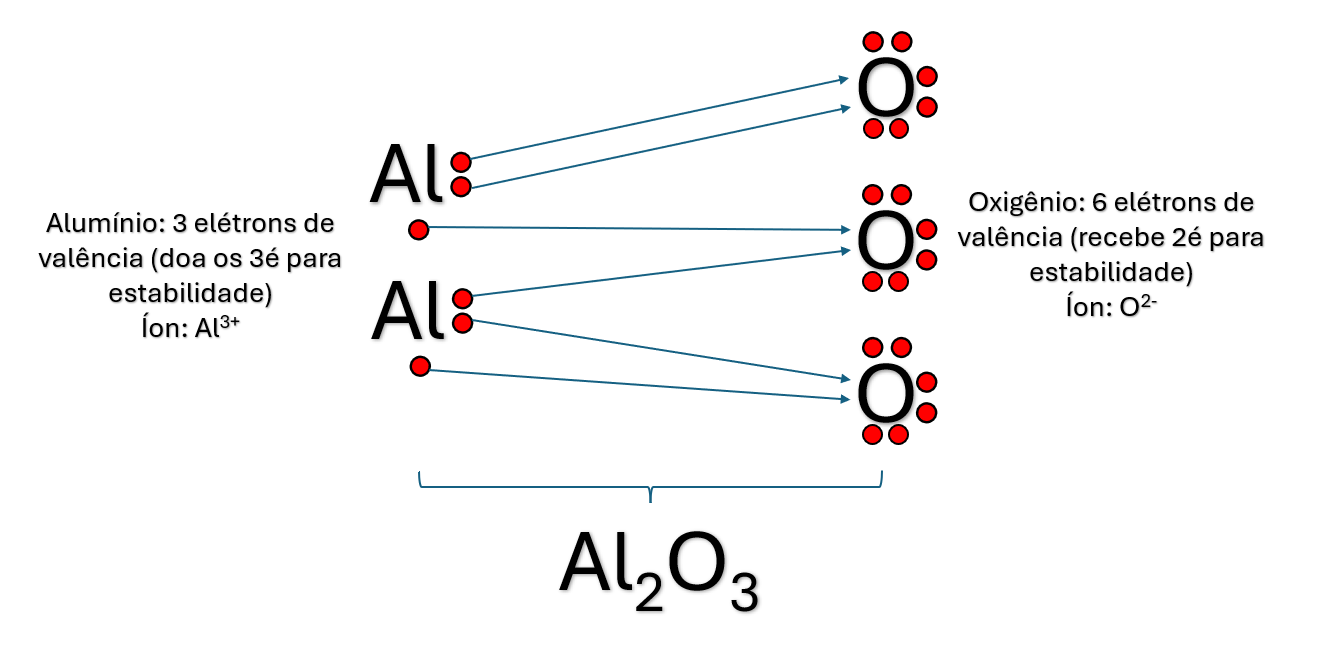
Podemos utilizar a íon-fórmula para identificar quantos átomos de cada elemento são necessários para estabilidade do composto. Nesse caso, ela é obtida pelo cruzamento das cargas dos íons metálicos (X) e não metálicos (Y); como resultado desse cruzamento, a carga de um transforma-se no índice atômico do outro (Figura 3).
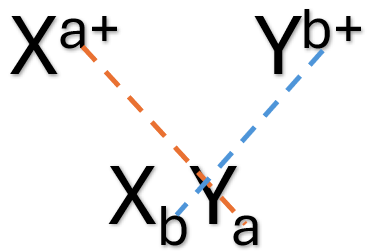
A ligação química iônica é denominada não direcional, significando que sua magnitude é a mesma em todas as direções ao redor do íon. Assim, na formação de materiais iônicos estáveis em um arranjo tridimensional, os vizinhos mais próximos dos íons positivos devem ser os íons negativos, e vice-versa. Como resultado dessa união de íons, os materiais que possuem predominantemente ligações iônicas são materiais duros, frágeis, de elevada temperatura de fusão e bons isolantes térmicos e elétricos. Essas propriedades são consequência direta das configurações eletrônicas e/ou da natureza da ligação iônica.
Conhecendo os elementos químicos que compõem o material, suas configurações eletrônicas e a natureza das ligações químicas, identificamos as propriedades que o material apresentará oriundas do tipo de ligação.
Por exemplo, materiais cerâmicos são formados por elementos metálicos e não-metálicos, com ligação química predominantemente iônica. Por essa razão, possuem alto ponto de fusão, são ótimos isolantes de energia, resistentes, duros e frágeis.
Ligação covalente e metálica
Existem três tipos de ligações químicas primárias: iônicas, covalentes e metálicas. A ligação covalente ocorre quando os átomos possuem tendências iguais de ganhar e/ou perder elétrons, caracterizando os elementos químicos não-metálicos e o hidrogênio. Por essa razão, a transferência total do elétron de um átomo para o outro não acontece, mas ocorre o compartilhamento dos elétrons entre os átomos envolvidos na ligação.
Átomos que apresentam alto valor de eletronegatividade, como os ametais, possuem alta capacidade em atrair elétrons. Contudo, quando eles interagem entre si, o fato de todos apresentarem alta atração pelos elétrons faz com que não ocorra a transferência efetiva destes, mas uma atração simultânea, ou seja, o compartilhamento dos elétrons pelos núcleos dos átomos, fazendo com que os átomos permaneçam unidos. Essa atração mútua ocorre até que a estabilidade química seja alcançada, ou seja, até que os elementos químicos cheguem a uma configuração semelhante ao dos gases nobres, seguindo a regra do octeto.
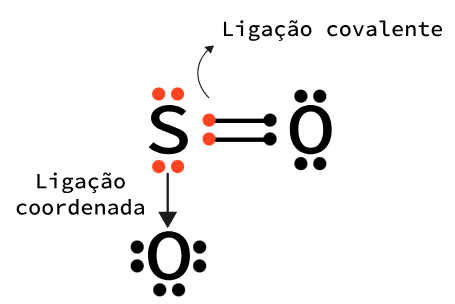
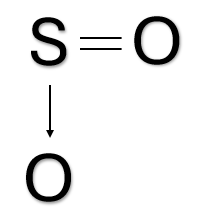
A ligação covalente pode ocorrer de quatro formas, dependendo de quantos e como os pares de elétrons são compartilhados. Elas podem ser simples (um par compartilhado), dupla (dois pares compartilhados), tripla (três pares compartilhados) e coordenada (os dois elétrons provêm do mesmo átomo).
Na fórmula estrutural de um composto, cada par de elétrons compartilhado é representado por uma barra; quanto à ligação covalente coordenada, ela é representada por uma seta. A Tabela 1 apresenta os tipos de ligações covalentes através de exemplos de moléculas conhecidas em nosso cotidiano por sua fórmula molecular, mostrando os pares compartilhados utilizando a estrutura de Lewis em sua fórmula eletrônica e as barras indicando as ligações em sua fórmula estrutural.
Fórmula molecular | Fórmula eletrônica | Fórmula estrutural |
H2O |
|
H—O—H
|
O2 |
|
O=O
|
N2 |
|
N≡N
|
SO2 |
|
|
Tabela 1 | Representação dos tipos de ligações covalentes. Fonte: elaborada pela autora.
Os compostos covalentes são bons isolantes térmicos, apresentam pontos de fusão e ebulição menores do que os compostos tipicamente iônicos, possuem elevado módulo de elasticidade, podem ser rígidos, frágeis, mas também dúcteis e maleáveis.
Esse tipo de ligação é encontrado em materiais cerâmicos à base de silicatos, vidros e nos materiais poliméricos. É interessante notar que tanto um material duro, como o diamante, quanto um material relativamente macio, como um polímero, contêm ligações covalentes. Essas diferenças são o resultado não apenas das ligações dentro das moléculas, mas também das ligações que as mantêm unidas.
Outro ponto relevante consiste em ser possível a existência de ligações interatômicas que são parcialmente iônicas e parcialmente covalentes em um mesmo material. De fato, são poucos os compostos que exibem ligações exclusivamente iônicas ou covalentes. O grau de cada tipo de ligação está associado à posição relativa de seus átomos constituintes na Tabela Periódica ou da diferença de suas eletronegatividades. Quanto maior for a diferença entre as eletronegatividades, maior o percentual iônico da ligação.
A quantidade iônica de uma ligação, também chamada de caráter iônico entre dois elementos, A e B, sendo A o elemento mais eletronegativo, pode ser aproximada pela Equação 1, sendo XA e XB as eletronegatividades dos respectivos elementos.
Como exemplo, o caráter iônico do cloreto de sódio (NaCl) pode ser calculado por (1), considerando os valores de eletronegatividade de 0,9 para o sódio e de 3,0 para o cloro. Assim, a porcentagem de caráter iônico é expressa em da seguinte forma:
Ou seja, o composto cloreto de sódio, NaCl, possui 67% de ligações iônicas e 33% de ligações covalentes.
Dessa forma, podemos afirmar que moléculas podem ser formadas por ligações covalentes, e compostos iônicos, por ligações iônicas. E nos metais e suas ligas, como ocorrem as ligações? Estas são conhecidas como ligações metálicas que apresentam, como características, boa condutividade elétrica e térmica, brilho característico e flexibilidade.
A ligação metálica ocorre entre os elementos metálicos (iguais ou diferentes) que possuem um, dois ou três elétrons na camada de valência. Nesse tipo de ligação, os elétrons de valência estão deslocalizados, ou seja, eles possuem probabilidade igual de estarem associados a qualquer um de seus átomos adjacentes, formando um mar de elétrons, ou nuvem eletrônica (Figura 4). Nessa nuvem eletrônica, os elétrons são considerados livres e é justamente por essa razão que os compostos metálicos apresentam boa condutividade elétrica e térmica.
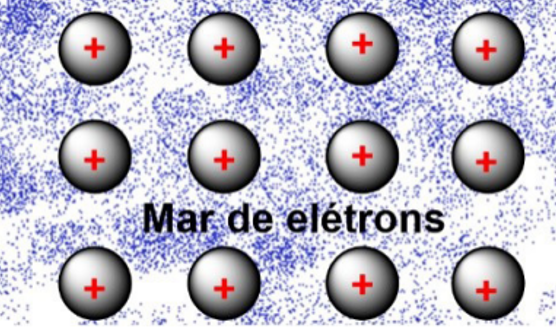
Ao analisar as propriedades periódicas de energia de ionização, comparando os átomos mais à direita da Tabela Periódica com átomos das famílias 1A e 2A, as propriedades metálicas se modificam, pois os compostos metálicos do grupo 1 e 2 tendem a ser mais maleáveis que compostos metálicos de cobre, por exemplo.
Por fim, as ligas metálicas são utilizadas para unir propriedades de diferentes metais ou modular propriedades de interesse em determinada utilização. Elas são definidas pela mistura de dois ou mais metais, podendo envolver elementos não metálicos.
Como exemplo de liga metálica, podemos citar o ouro 18 (em que prata ou cobre são adicionados para deixar o ouro menos maleável, possibilitando a utilização fabricação de joias) e o aço (em que uma quantidade específica de carbono é adicionada no ferro, aumentando a resistência mecânica).
Comportamentos gerais dos materiais podem ser explicados pelo tipo de ligação química que possuem. De maneira geral, os materiais metálicos e suas ligas são bons condutores de energia como consequência de seus elétrons livres; já os materiais com ligações iônicas ou covalentes são tipicamente isolantes por não possuírem elétrons livres.
Siga em Frente...
Ligações de van der Waals
Para a formação dos materiais, além das ligações químicas primárias, consideradas fortes por ocorrerem entre os átomos e/ou íons, também existem as mais fracas, conhecidas como ligações secundárias, que ocorrem entre as moléculas, e, por vezes entre átomos, também chamadas de interações ou forças intermoleculares, ou simplesmente ligações de van der Waals.
Nas ligações químicas secundárias, não há doação ou compartilhamento dos elétrons de valência. Elas normalmente são formadas quando ocorre uma distribuição de cargas desigual, criando um dipolo, de carga total zero, mas com uma das extremidades com carga positiva ou negativa em relação à outra extremidade. Esses dipolos podem ser produzidos por uma flutuação aleatória dos elétrons em torno do que é normalmente um campo elétrico simétrico no átomo. Uma vez que um dipolo aleatório é formado em um átomo, um dipolo induzido é formado no átomo adjacente (Figura 5).
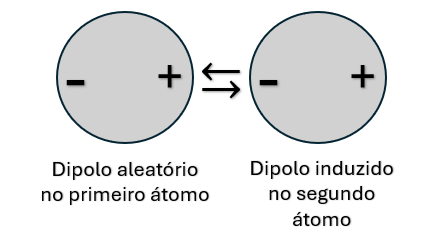
Uma ligação secundária também pode estar presente quando uma molécula apresenta um dipolo permanente em função de uma disposição assimétrica das regiões positivas e negativas. Essa molécula com dipolo permanente pode induzir, nas moléculas adjacentes, um dipolo simétrico, formando uma ligação fraca, ou constituir ligações químicas secundárias com outras moléculas que também apresentem dipolo permanente. Vale dizer que materiais provenientes desse tipo de ligação secundária apresentam baixas temperaturas de fusão e ebulição.
Dentre os tipos de ligações de van der Waals, a mais importante é conhecida como forças de London, em que há interações entre dipolos induzidos em átomos ou moléculas, levando à diminuição da energia do sistema, estabilizando-o.
Outro tipo de ligação secundária é a chamada ligação de hidrogênio, ou ligações de dipolos permanentes. Ela é considerada a forma mais forte das ligações secundárias, formada a partir da natureza polar de moléculas que contenham átomos de hidrogênio. Como exemplo, podemos observar a ligação entre as moléculas de água (H2O), em que o único elétron que o hidrogênio possui é compartilhado com o oxigênio. Assim, o lado da ligação em que se encontra o hidrogênio torna-se carregado positivamente, exercendo força de atração na molécula adjacente, com extremidade carregada positivamente. Além disso, como consequência dessa ligação, pontos de fusão e ebulição de materiais que contenham ligações de hidrogênio são muito elevados em relação aos pesos atômicos que possuem.
Logo, tanto as ligações de van der Waals quanto as ligações de hidrogênio (muitas vezes chamadas de ponte de hidrogênio) são fracas se comparadas às ligações primárias pelo fato de serem resultantes das forças de atração entre dipolos elétricos induzidos ou permanentes.
Vamos Exercitar?
Retomando o problema proposto inicialmente, você foi acionado para realizar uma pesquisa sobre a possibilidade de substituir os fios de cobre, que são utilizados na fiação elétrica de automóveis, por alumínio. Se houver essa possibilidade, quais características químicas devem ser levadas em consideração nessa escolha?
Para o desenvolvimento desta atividade, será necessário compreender as características que o material cobre apresenta e entender por que é utilizado na fiação elétrica de automóveis. Na sequência, será preciso avaliar a possibilidade de troca de material por alumínio e verificar o custo-benefício do processo.
O elemento químico cobre (Cu), consultando a tabela periódica, é um metal de transição de número atômico 29. Realizando a distribuição eletrônica desse elemento, sua camada de valência apresentará apenas um elétron (4s1). Para a formação de um composto, os átomos de cobre ligam uns aos outros através da ligação metálica. Como característica desse tipo de ligação, a nuvem eletrônica permite que o material seja excelente condutor de energia (eletricidade e térmica) e, por apresentar boa ductilidade, pode ser facilmente moldado em fio. São essas propriedades que tornam esse material tão utilizado na forma de fios, não apenas em automóveis, mas em qualquer aplicabilidade de fiações.
Contudo, existem alguns estudos que sugerem a possibilidade de se utilizar alumínio no lugar do cobre. O alumínio, assim como o cobre, também é um elemento químico metálico de número atômico 13, com 3 elétrons de valência. Para a formação do composto, os átomos de alumínio se ligam uns aos outros através da ligação metálica.
Devido às propriedades periódicas do alumínio e ao tipo de ligação química que realiza para a formação do material, pode-se afirmar que ele é um metal macio, dúctil e resistente à corrosão, apresentando baixa densidade e excelente condutividade térmica e elétrica.
Em um primeiro momento, essas características tornam a substituição de fios de cobre por fios de alumínio viável. Ademais, por apresentar baixa densidade, alguns estudos apontam que utilizar fios de alumínio em automóveis pode reduzir em até 48% a massa final da fiação elétrica.
Saiba Mais
Olá, estudante!
Compreender os tipos de ligações químicas que estão presentes nos materiais e relacioná-los às propriedades por eles apresentadas é de grande valia para análises preliminares nos materiais em aplicações específicas, principalmente quando houver a possibilidade de substituição de material por outro visando a melhora das propriedades e custo-benefício.
Saiba mais sobre os tipos de ligações primárias e secundárias estudando as seções de 2.6 a 2.8 do livro Ciência e engenharia de materiais: uma introdução, de William D. Callister Jr.
Faça os exercícios propostos para fixar os conteúdos relacionados a este tema.
Bons estudos!
Referências Bibliográficas
ASKELAND, D. R.; WRIGHT, W. J. Ciência e engenharia dos materiais. São Paulo: Cengage Learning Brasil, 2019. E-book. ISBN 9788522128129. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788522128129/. Acesso em: 2 mar. 2024.
ATKINS, P. Físico-Química: fundamentos. 6. ed. Rio de Janeiro: Grupo GEN, 2017. E-book. ISBN 9788521634577. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521634577/. Acesso em: 3 mar. 2024.
CALLISTER JR., W. D. Ciência e engenharia de materiais: uma introdução. Rio de Janeiro: Grupo GEN, 2020. E-book. ISBN 9788521637325. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521637325/. Acesso em: 2 mar. 2024.
DREKENER, R. L.; SIMÊNCIO, E. C. A. Química e ciência dos materiais. Londrina : Editora e Distribuidora Educacional S.A., 2019. KOTZ, J. C. et al. Química geral e reações químicas. São Paulo: Cengage Learning Brasil, 2023. v. 1. E-book. ISBN 9786555584516. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9786555584516/. Acesso em: 3 mar. 2024.
MAIA, D. J.; BIANCHI, J. C. de A. Química geral e fundamentos. São Paulo: Pearson Prentice Hall, 2007. 448 p. NEWELL, J. Fundamentos da moderna engenharia e ciência dos materiais. Rio de Janeiro: Grupo GEN, 2010. E-book. ISBN 978-85-216-2490-5. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/978-85-216-2490-5/. Acesso em: 2 mar. 2024.
SMITH, W. F.; HASHEMI, J. Fundamentos de engenharia e ciência dos materiais. Porto Alegre: Grupo A, 2012. E-book. ISBN 9788580551150. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788580551150/. Acesso em: 2 mar. 2024.
Aula 4
Estado da matéria: gases, líquidos e sólidos
Estado da matéria: gases, líquidos e sólidos
Olá, estudante! Nesta videoaula, abordaremos os conceitos relacionados aos principais estados que a matéria pode apresentar (sólido, líquido e gasoso), avaliando as propriedades fundamentais para a sua diferenciação e como ocorrem as mudanças de fase. Ademais, compreenderemos como descrever a matéria no estado gasoso através da lei dos gases ideais com exemplos do cotidiano e aplicações visando a prática profissional.
Os conceitos desta aula são, pois, fundamentais para compreender os estados em que a matéria pode ser encontrada, bem como quais as situações que provocam ou permitem a mudança entre as fases. Ter esse conhecimento é de grande valia para o seu desenvolvimento profissional, sendo possível a escolha e utilização de qualquer material conforme as especificações do projeto, levando em consideração a segurança e o custo-benefício.
Pronto para mais esse desafio?
Bons estudos!
Ponto de Partida
Olá, estudante! Bem-vindo!
Nesta aula, abordaremos as propriedades fundamentais e a classificação da matéria, com o foco no estado gasoso, estudando a lei dos gases e suas aplicações, além de conceitos importantes para a compreensão das características de um composto em cada estado físico (sólido, líquido ou gasoso), analisando suas propriedades e as situações em que ocorre a mudança de estado. Além disso, buscaremos compreender a relação das propriedades pressão, temperatura e volume em um dado exemplo ou na análise de um processo termodinâmico.
Conceitos estes que podem ser utilizados e aplicados em diversas áreas da Engenharia, por exemplo, em novas tecnologias de embalagens que visam aumentar o prazo de validade dos alimentos. Embalagens como essas apresentam dois tipos de classificação: Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP).
As Embalagens de Atmosfera Modificada Tradicionais (MAP) são embalagens fechadas que podem utilizar gases do tipo hélio (He), neônio (Ne), argônio (Ar) e criptônio (Kr) em seu interior, mas também dióxido de carbono (CO2) e gás oxigênio (O2) em proporções adequadas, mantendo alguns aspectos dos alimentos como cor, forma e frescor. Já as Embalagens de Atmosfera Modificada em Equilíbrio (EMAP) podem utilizar uma atmosfera modificada formada por dióxido de carbono (CO2) e gás oxigênio (O2), além de apresentar microperfurações na sua superfície. O objetivo da atmosfera modificada equilibrada nesse tipo de embalagem consiste, portanto, em aumentar o prazo de validade para frutas e legumes frescos sem o uso de qualquer tipo de conservante.
Visando tal objetivo, um produtor local de hortaliças contatou a empresa da qual você faz parte, solicitando uma consultoria para ver a viabilidade do processo. Para a obtenção das informações, você foi acionado para verificar o volume final de gás que será utilizado em cada embalagem. Nesse processo, será utilizado o argônio que, imediatamente após ser colocado na embalagem, assume o comportamento de um gás ideal. Para os cálculos, alguns dados foram fornecidos: pressão de 1 atm, temperatura de 27ºC e massa de 0,16 g.
Então, vamos conhecer os conceitos necessários para resolução do problema proposto?
Bons estudos!
Vamos Começar!
Propriedades fundamentais
A definição mais simples de matéria é dada por aquilo que possui massa e ocupa lugar no espaço. Enquanto massa (m), expressa a quantidade de matéria que compõe um corpo e, pela segunda lei de Newton, está relacionada à resistência (inércia) de um corpo para entrar em movimento acelerado. Assim, quanto maior a massa de um corpo, maior a sua inércia.
E como podemos expressar o espaço que a matéria ocupa? Pelo volume (V), já que sua definição é dada pelo espaço ocupado por um corpo ou a capacidade que ele tem de comportar alguma substância.
A proporção entre massa (m) e volume (V) é conhecida como densidade (ρ), também chamada de massa específica. Ela expressa o quanto de massa de material é necessário para ocupar um volume específico. No Sistema Internacional (SI), sua unidade é mas usualmente utilizamos . Matematicamente, a equação para densidade é dada por (1).
Basicamente, a matéria existe em três formas (estados): sólido, líquido e gasoso. Os materiais em estado sólido apresentam forma rígida, ocupando porções definidas no espaço, e volume fixo, apresentando pequenas mudanças com a variação de temperatura e pressão. Os materiais em estado líquido também ocupam porções definidas no espaço, como os sólidos, mas não apresentam volume fixo, tomando a forma do recipiente em que são alocados. Por fim, materiais em estado gasoso não ocupam porções definidas do espaço e não possuem formas definidas, ou seja, seu volume é determinado pelo recipiente que os contêm. A Figura 1 traz uma representação dos estados da matéria, que pode mudar seu estado físico (sólido, líquido ou gasoso) mantendo sua composição química.
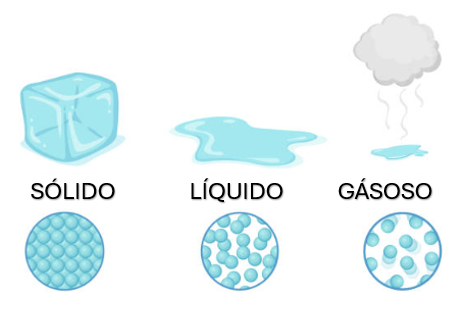
Qualquer matéria pode existir em um de seus três estados. Para todos os casos, ela estará em estado sólido para a temperatura mais baixa de sua constituição. À medida que a temperatura aumenta, os elementos que constituem o material se fundem e ocorre a formação da fase líquida. Para temperaturas ainda maiores, os líquidos se evaporam para formar gases. Nesse processo, a variação do volume do composto acompanha a mudança de estado: aumentando com o aumento da temperatura e diminuindo com a diminuição da temperatura. Contudo, a água é uma exceção significativa dessa regra, apresentando expansão do volume no resfriamento, na mudança de fase de líquido para sólido. Esse fenômeno é conhecido como caso anômalo da água.
Para facilitar a compreensão das propriedades dos estados da matéria, a teoria cinética molecular da matéria afirma que toda matéria é constituída por átomos, moléculas ou íons que estão em constante movimento. Nessa teoria, as fases da matéria são explicadas através do arranjo atômico que possuem, ou seja:
- Sólido: nesse estado, as partículas que compõe a matéria estão muito próximas umas das outras, normalmente apresentando um arranjo atômico regular. Essas partículas vibram com pouca intensidade, visto a baixa temperatura do material, e raramente uma partícula em um sólido ultrapassa suas vizinhas de modo a entrar em contato com um novo conjunto de partículas.
- Líquido: possuem arranjo atômico irregular e vibram com mais intensidade que os sólidos. Isso faz com que as partículas não apresentem confinamento em posições específicas, podendo mover-se e ultrapassar outras partículas.
- Gasoso: em situações normais, as partículas em um gás encontram-se bem distantes umas das outras devido à alta intensidade de vibração em função da elevada temperatura. Por essa razão, as moléculas de um gás se movem com extrema rapidez e não são confinadas por suas vizinhas, colidindo umas com as outras e com as paredes do recipiente ao qual estão alocadas. Esse movimento aleatório permite que elas preencham seu recipiente, de forma que o volume de uma amostra de gás equivale ao volume do recipiente.
Para a formação da matéria, em qualquer estado físico que se encontra, há força de atração entre suas partículas. Essa força é mais forte em sólidos e menos intensa em gases e possuem papel significativo na determinação das propriedades da matéria.
Uma substância pode apresentar mudança de fase absorvendo ou cedendo energia na forma de calor, aumentando ou diminuindo sua temperatura, respectivamente. Essas mudanças de estado de matéria recebem nomes especiais, por exemplo: a transformação do sólido para líquido é chamada de fusão, líquido para vapor é chamada de vaporização, gás para líquido é chamada de condensação, enquanto do líquido para sólido é chamada de solidificação. Essas mudanças de fase são apresentadas resumidamente pela Figura 2.
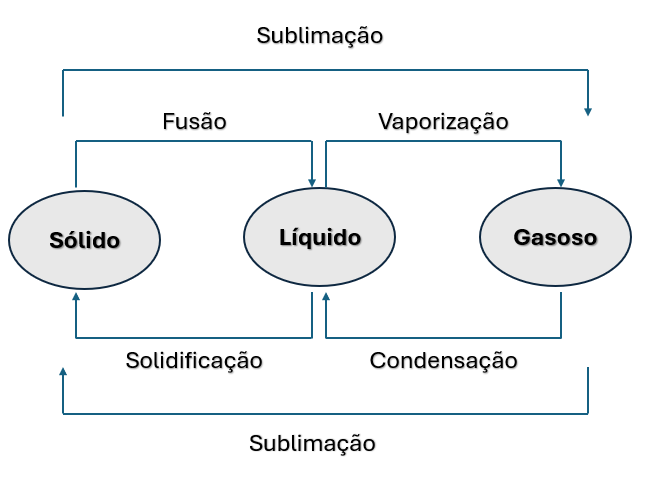
Dessa forma, as principais mudanças de fase da matéria são definidas como:
- Fusão: quando ocorre a mudança do estado sólido para o estado líquido.
- Vaporização: quando ocorre a mudança do estado líquido para o estado gasoso, podendo se dar de três formas: líquido que passa para o estado gasoso abaixo da temperatura de ebulição (evaporação); líquido passa para o estado gasoso na temperatura de ebulição (ebulição); e líquido passa para o estado gasoso acima da temperatura de ebulição (calefação).
- Liquefação ou condensação: quando ocorre a mudança do estado gasoso para o estado líquido.
- Solidificação: quando ocorre mudança do estado líquido para o estado sólido.
- Sublimação: quando ocorre a mudança do estado sólido para o estado gasoso e vice-versa.
Por fim, à pressão constante, a temperatura de fusão, ou ponto de fusão, é a temperatura em que uma substância pura passa do estado sólido para o estado líquido. Do mesmo modo, a temperatura na qual uma substância passa do estado líquido para o estado gasoso é chamada de temperatura de ebulição ou ponto de ebulição.
As mudanças de estados da matéria são, portanto, fundamentais para compreender a maior parte dos fenômenos naturais que ocorrem diariamente. O exemplo mais simples é o da água que, ao longo de um mesmo dia, muda de fase em diversos fenômenos observados (chuva, fazer um café, vapor no banheiro enquanto toma um banho quente, entre outros).
Siga em Frente...
Classificação da matéria
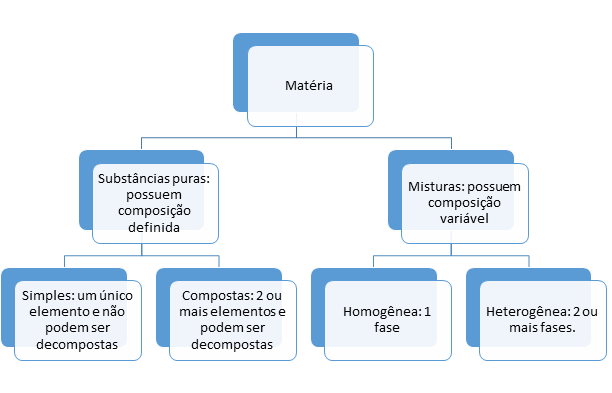
A matéria pode ser classificada em substâncias puras ou misturas (homogêneas ou heterogêneas). Por definição, substância pura é denominada a substância que apresenta composição química invariável e homogênea. Ela pode existir em mais de uma fase, mas sua composição será a mesma em todas as fases.
A água é um bom exemplo para que possamos compreender uma substância pura. Imagine um copo com água líquida e um gelo. Nesse caso, temos o composto água em duas fases distintas, mas de mesma composição química (H2O).
Ademais, a substância pura pode ser dada de duas formas: pura simples e pura composta. A substância pura será simples quando o composto for constituído por apenas um tipo de elemento químico, como os gases oxigênio (O2) e nitrogênio (N2), contendo apenas os elementos oxigênio e nitrogênio, respectivamente, na formação da matéria.
Já a substância composta é formada por elementos químicos diferentes, como a água (H2O), que contém os elementos hidrogênio (H) e oxigênio (O), ou o gás dióxido de carbono (CO2), com os elementos carbono (C) e oxigênio (O).
Mas como identificar quando uma substância é considerada pura, independentemente de ser simples ou composta? Uma substância é considerada pura quando as mudanças de fase ocorrerem completamente e em uma temperatura fixa, ou seja, quando todas as moléculas da substância mudarem de fase na mesma temperatura.
Novamente, a água é um bom exemplo para entendermos esse conceito. O gelo (água no estado sólido) começa a liquefazer, em pressão atmosférica, a aproximadamente 0ºC. Essa temperatura é mantida até que a última molécula de água no estado sólido altere para o estado líquido. O mesmo acontece no processo de vaporização, em que a primeira molécula muda de estado líquido para sólido a aproximadamente 100ºC, e essa temperatura é mantida até que a última molécula altere o seu estado físico.
Outra característica de uma substância pura é que nenhuma técnica física é capaz de separá-la em duas ou mais espécies diferentes a temperaturas ordinárias. Se fosse possível a separação, a substância seria classificada como uma mistura.
Uma mistura é, assim, definida por duas ou mais substâncias puras que podem ser separadas aplicando técnicas físicas. Ela pode ser homogênea, quando não se percebe a diferença entre as moléculas que compõem a substância por estarem em mesma fase e apresentarem mesmas propriedades químicas em toda sua extensão, como o açúcar dissolvido completamente na água), ou heterogênea, quando as moléculas que a constituem apresentam-se em mais de uma fase, de propriedades diferentes, como óleo na água. A Figura 3 apresenta um exemplo de substâncias homogêneas e heterogêneas.
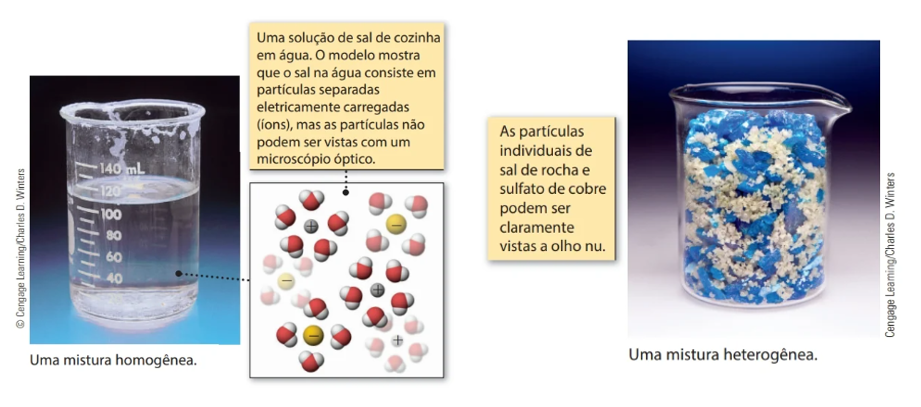
Normalmente, as misturas heterogêneas são identificadas visualmente. Contudo, existem alguns tipos de misturas que parecem uniformes, mas não o são. O leite, por exemplo, parece ter uma textura lisa a olho nu, mas olhar ao olharmos mais de perto (com o auxílio de um microscópio), veremos a existência de glóbulos de gordura e proteínas no líquido.
Além disso, as propriedades de uma matéria podem ser do tipo extensivas ou intensivas, ou seja, dependentes da massa das substâncias ou não dependentes. Assim, as propriedades extensivas dependem da quantidade de substância presente, variando de forma proporcional ao tamanho ou à quantidade de massa em um sistema. Massa, volume, energia interna, entalpia e entropia são exemplos de propriedades extensivas.
Já as propriedades intensivas são aquelas que não dependem da quantidade de substância, mas levam em consideração o tipo a ser avaliado. Pressão, temperatura, massa específica (densidade), energia interna específica, entalpia específica e entropia específica são exemplos de propriedades intensivas. Também são exemplos de propriedades intensivas o ponto de fusão o e ponto de ebulição.
É importante ressaltar que uma propriedade extensiva pode ser transformada em propriedade intensiva dividindo seu valor pela massa do sistema. Como exemplo, temos o volume específico, definido pelo volume da substância dividido por sua massa.
Consideremos uma amostra de 27,2 g de mercúrio líquido ocupando um volume de 2,00 cm3. O mercúrio líquido possui ponto de fusão a temperatura de 234 K e densidade de 13,6 g/cm3. Observando as propriedades fornecidas, tanto a massa quanto o volume da amostra dependem da quantidade de material presente. Portanto, massa e volume são propriedades extensivas. Já o ponto de fusão e a densidade são propriedades intrínsecas ao material, independentemente da quantidade de matéria existente. Assim, o ponto de fusão e a densidade são propriedades intensivas.
Ademais, as propriedades intensivas muitas vezes são utilizadas para identificar o tipo de material existente. Por exemplo, a temperatura de fusão, em pressão atmosférica, pode ser usada para identificar o tipo de sólido existente.
Outra categorização da matéria consiste na distinção entre propriedades físicas e propriedades químicas. Uma propriedade física pode ser observada ou medida sem mudar a identidade da matéria (ou seja, sua composição química), enquanto uma propriedade química se refere à capacidade de uma substância de se transformar em outra.
Lei dos gases
De maneira geral, o comportamento dos gases é o mais simples de ser entendido, quando visualizado a nível molecular, ao ser comparado aos outros dois estados da matéria (sólido e líquido). Ao observar o comportamento das moléculas que constituem a substância, é possível descrever as propriedades na fase gasosa. Para tanto, é necessário que os valores de pressão (p), volume (V), temperatura (T, em Kelvin) e quantidade de matéria (número de mol) do gás seja conhecido.
Volume é uma das propriedades de um gás e indica as dimensões do local em que está. Já a temperatura está associada à energia térmica que as moléculas possuem (quanto maior a temperatura, maior a energia térmica, maior o movimento das moléculas). Quando à quantidade de matéria, ela lida com o número de moléculas que constituem a porção de gás que será estudada. Por fim, a pressão é definida pela força (F) exercida sobre um objeto em razão da área (A) de aplicação da força (Equação 2), Cuja unidade de medida, no SI, é dada por Pascal (Pa), em que
Outras unidades para pressão são: milímetro de mercúrio (mm Hg), atmosfera (atm) e bar. Assim, a relação entre as grandezas é expressa da seguinte forma:
As propriedades volume e temperatura são alteradas com a variação da pressão. Por exemplo, quando uma quantidade de gás está confinada em um frasco de volume V1, terá uma pressão p1. Alterando o volume para V2, como o sistema é fechado, surgirá uma nova pressão p2. Nesse caso, se o volume aumentar, a pressão será menor; já se o volume diminuir, a pressão será maior, uma vez que o gás ocupar menos espaço. O fato de o gás ocupar mais ou menos espaço está associado à propriedade de expansibilidade e compressibilidade dos gases, respectivamente.
Outra propriedade que afeta o volume de um gás é a temperatura. Como a temperatura está associada à agitação térmica das moléculas, quanto maior a temperatura, maior o volume que o gás ocupa. Quanto menor a temperatura, menor esse volume.
Para comprovar essa teoria, faça a seguinte experiência: infle um balão (ou uma bexiga), amarre e coloque a bexiga cheia na geladeira. No dia seguinte, abra a geladeira e veja como está o balão: ele estará murcho. Contudo, ao tirar da geladeira, imediatamente ele começará a “encher” novamente, mesmo estando amarrado. Essa situação ocorre pela variação da temperatura do gás dentro do balão: baixa temperatura = baixo volume, alta temperatura = alto volume.
Tanto a temperatura quanto a pressão estão relacionadas com o volume pelas leis de Boyle e de Charles, respectivamente. Pela lei de Boyle, se conhecermos os valores de pressão e volume de uma quantidade n de um gás, à temperatura fixa, será possível obter essas características para um estado final, dada por (4).
Já, pela lei de Charles, podemos dizer que com uma quantidade n de gás e pressão constantes, o volume e a temperatura de uma condição inicial estão relacionados com o volume e a temperatura de uma condição final por:
Agrupando as Equações 4 e 5, é possível chegar à lei geral dos gases, possibilitando o estudo do comportamento de um gás quando há variação da pressão, volume e temperatura. Essas relações são expressas no Quadro 1.
Lei de Boyle: para determinada quantia de gás (n) a uma temperatura fixa (T), o volume do gás diminui se a pressão aumenta. Por outro lado, se a pressão diminui, o volume do gás aumenta. |
p=CB x 1V
Com n e T constantes. |
Lei de Charles: para uma determinada quantia de gás (n) a uma pressão fixa (p), o volume do gás diminui se a temperatura diminui. Já se a temperatura aumenta, o volume do gás também irá aumentar. |
V=Cc x T
Com n e p constantes T em Kelvin |
Lei geral dos gases: baseada nas observações de Boyle e Charles, relaciona pressão (p), volume (V) e temperatura (T). |
p1V1T1=p2V2T2
Para uma quantia n de gás, com T em Kelvin |
Quadro 1 | Lei dos gases. Fonte: elaborado pela autora.
Com as equações apresentadas no Quadro 1, é possível obter a lei dos gases ideais utilizando uma constante de proporcionalidade R. Assim, teremos:
pV = nRT
em que a constante R é chamada de constante universal dos gases, dada por 8,31 J/mol K ou 0,082 L atm/K mol.
A partir dessa equação, algumas considerações são possíveis:
- Para temperatura e número de moléculas constante, ao diminuirmos o volume do recipiente que contém um gás, aumentamos as colisões das moléculas contra elas mesmas e contra as paredes do recipiente, aumentando a pressão. Nesse caso, a pressão é calculada por
- Para temperatura e volume constantes, ao aumentarmos o número de moléculas em um recipiente de volume fixo, aumentamos os choques moleculares e contra as paredes do recipiente, aumentando a pressão. Nesse caso, a pressão será calculada por
- Para o número de moléculas e volume constantes, a pressão é decorrente da razão entre a força das colisões e a área. Ao aumentarmos a temperatura, aumentamos a energia cinética das moléculas, portanto aumentamos a força das colisões, aumentando, assim, a pressão. Nesse caso, a pressão é calculada por
- Para a pressão constante, ao aumentarmos o número de moléculas, aumentamos os choques e, para que a pressão permaneça constante, ou o volume aumenta ou a temperatura devido à maior energia cinética média do sistema. Assim, o volume pode ser calculado por
Como exemplo, vamos considerar que um gás ideal à temperatura de 0ºC possui um de 0,5 m3 e pressão p1. Alterando os valores de pressão e temperatura, em um novo estado, para p2 = 0,5p1 e T2 = 10T1, qual será o novo volume (V2)?
Para obter o novo volume (V2), podemos aplicar a lei dos gases ideais considerando os dois estados. No estado 1, a lei dos gases ideais será expressa pela Equação 7 e, no estado 2, pela Equação 8.
Nesse caso, observamos que a quantidade de gás (n) não é alterada no processo e, como o gás é ideal, a contante universal dos gases R permanece a mesma. Isolando nas Equações 7 e 8, teremos, respectivamente.
Como o produto será o mesmo tanto no estado 1, quanto no estado 2, igualando as Equações 9 e 10, teremos:
Substituindo os valores fornecidos em (11), obtemos o novo volume V2 por:
Dessa forma, o novo volume será de .
A lei dos gases ideais é completamente aplicável aos gases próximos à temperatura ambiente, com uma pressão de 1 atm. Em outras condições, ocorrem alguns desvios na relação pVT, isso devido à suposição de que moléculas de gases possuem volumes desprezíveis e de que não há nenhum tipo de força entre elas.
Vamos Exercitar?
Retomando o problema proposto inicialmente, você foi acionado para verificar o volume final de gás em cada embalagem. Para garantir o aumento na validade dos produtos, foi proposta a utilização do gás argônio que, imediatamente após a colocação do gás na embalagem, assume o comportamento de um gás ideal. Para o desenvolvimento dos cálculos, alguns dados foram fornecidos: pressão de 1 atm, temperatura de 27ºC e massa de 0,16 g. Com esses dados, o volume ocupado pelo gás na embalagem pode ser calculado.
Foi informado que, em cada embalagem, será utilizado 0,16 g de Ar. O primeiro passo é obter esse valor em quantidade de matéria, ou seja, em mol. Consultando a tabela periódica, a massa atômica do argônio apresenta valor de 40 g/mol. Assim, o número de mols pode ser calculado pela Equação 13, em que m representa a massa do composto e MAr a massa atômica.
Com o número de mols de argônio, o volume pode ser calculado pela lei dos gases ideais. Lembrando que a constante universal dos gases apresenta valor de 8,31 J/mol K ou 0,082 L atm/K mol. O cálculo do volume é expresso por (14), lembrando que a temperatura deve ser utilizada em Kelvin (K).
Assim, o volume de gás em cada embalagem será de 98,4 mL. Com esse dado, é possível fazer um orçamento do custo bruto para cada embalagem, pensar em condições de transporte (logística de transporte) e projetar um valor para o produto considerando a margem de lucro requerida.
Saiba Mais
Olá, estudante!
Veja os conceitos na prática, através da execução dos experimentos nos simuladores propostos a seguir, na plataforma Phet:
- PHET. Estados da matéria, 2024. Sobre.
- PHET. Densidade, 2024. Sobre.
- PHET. Propriedades dos gases, 2024. Sobre.
Bons estudos!
Referências Bibliográficas
ATKINS, P. Físico-Química: fundamentos. 6. ed. Rio de Janeiro: Grupo GEN, 2017. E-book. ISBN 9788521634577. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521634577/. Acesso em: 3 mar. 2024.
BORGNAKKE, C.; SONNTAG, R. E. Fundamentos da termodinâmica. São Paulo: Editora Blucher, 2018. E-book. ISBN 9788521207931. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521207931/. Acesso em: 8 mar. 2024.
HALLIDAY, D.; RESNICK, R.; KRANE, K. S. Física. Rio de Janeiro: Grupo GEN, 2017. v. 2. E-book. ISBN 978-85-216-1946-8. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/978-85-216-1946-8/. Acesso em: 8 mar. 2024.
HEWITT, P. G. Física conceitual. Rio Grande do Sul: Grupo A, 2023. E-book. ISBN 9788582605899. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788582605899/. Acesso em: 8 mar. 2024.
KOTZ, J. C. et al. Química geral e reações químicas. São Paulo: Cengage Learning Brasil, 2023. v. 1. E-book. ISBN 9786555584516. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9786555584516/. Acesso em: 3 mar. 2024.
Encerramento da Unidade
Estrutura atômica
Videoaula de Encerramento
Olá, estudante! Nessa videoaula você irá conhecer os principais conceitos da estrutura da matéria. Compreenderá a constituição fundamental dos átomos, os tipos de elementos químicos existentes, a diferença entre eles, como obter algumas informações através da tabela periódica e a forma pelo qual os átomos se unem na formação de substâncias e compostos. E ainda, entenderá os estados que a matéria pode apresentar, suas características e situações simples de mudanças de fases. Por fim, com o foco no estado gasoso, compreenderá como utilizar a equação dos gases ideias em problemas de engenharia.
Conteúdos importante para sua prática profissional, pois através deles será possível conhecer os materiais e suas propriedades, permitindo seleção e escolha adequada de material para aplicação requerida, visando as condições de segurança, qualidade, custo e benefício.
Prepare-se para essa jornada do conhecimento!
Bons estudos!
Ponto de Chegada
Olá, estudante! Para desenvolver a competência dessa unidade, que é conhecer e compreender os conceitos básicos sobre átomos, ligações químicas e estados da matéria, assim como sua importância dentro do estudo da Química e Ciência dos Materiais, você deve primeiramente entender a constituição fundamental do átomo através do modelo atômico.
Basicamente, o átomo é formado por um núcleo massivo e denso, onde estão alocados os prótons e os nêutrons. Ao redor do núcleo, em movimento orbital, os elétrons estão alocados em níveis discretos de energia, chamado de eletrosfera.
Para identificar o local provável em que o elétron está, é necessário realizar a distribuição eletrônica dos elétrons nos níveis e subníveis atômicos, considerando os estados crescentes de energia. Essa distribuição é possível através da utilização dos números quânticos e da análise energética de Linus Pauling.
E, através da configuração eletrônica do elemento químico, sabemos qual a camada de valência e quantos elétrons ela possui (denominado elétrons de valência). São exatamente esses elétrons que participam das ligações químicas.
Vejamos um exemplo, o cálcio (Ca) é um elemento químico que possui 20 prótons e 20 elétrons em seu estado neutro. Sua configuração eletrônica é dada por 1s22s22p63s23p64s2. A camada 4 (n = 4) é o nível mais energético preenchido, ou seja, para esse elemento a camada 4 é a camada de valência. Nela, estão 2 elétrons, que são os elétrons de valência, responsáveis pelas possíveis ligações químicas que esse elemento possa realizar.
E como saber quantos elétrons um átomo de determinado elemento químico possui? Através do número atômico (Z). Os elementos químicos são designados pelo seu número atômico (quantidade de prótons no interior do núcleo) e, para átomos neutros, o número de prótons é o mesmo número de elétrons.
O número atômico de cada elemento pode ser obtido através da tabela periódica, local em que os elementos químicos foram ordenados seguindo o número atômico que possui, dentre outras propriedades, denominadas de propriedades periódicas.
As substâncias, compostos ou materiais são formados através de ligações químicas, forma pela qual há a união de átomos e/ou substância na constituição da matéria. As ligações químicas são classificadas como primárias (fortes) ou secundárias (fracas). As ligações primárias se dão de três tipos: iônica, covalente e metálica. Já as ligações secundárias são denominadas pelas ligações de van der Waals e as pontes de hidrogênio.
As ligações iônicas ocorrem entre elementos metálicos e não metálicos, com transferência de elétrons para alcançar a estabilidade química (oito elétrons na camada de valência). Nesse caso, os elementos metálicos doam os elétrons de valência (se transformando em íons positivos – cátions) enquanto os não metálicos os recebem (se transformando em íons negativos – ânions).
Como exemplo de ligação iônica temos o composto cloreto de magnésio (MgCl2). Nele, o magnésio (Mg – elemento metálico com 2 elétrons de valência) doa seus elétrons de valência para o cloro (Cl – elemento não metálico com 7 elétrons de valência). Assim, para que ocorra a estabilidade química dos compostos na ligação, para cada átomo de magnésio, 2 de cloro.
Além da ligação iônica, temos a ligação covalente. Essa ligação química ocorre entre elementos não metálicos e o hidrogênio, em que os elétrons de valência são compartilhados para que a estabilidade química ocorra. Dependendo do composto, as ligações covalentes podem ser do tipo simples (um par de elétrons compartilhado), dupla (dois pares de elétrons compartilhados), tripla (três pares de elétrons compartilhados) ou coordenada (átomo estável compartilha um par de elétrons com outro átomo, representado por uma seta).
Como exemplo de ligação covalente temos o composto água (H2O), formada por 2 hidrogênios para cada oxigênio. Para formação dessa molécula, o hidrogênio precisa de um elétron e o oxigênio de 2 elétrons para a estabilidade química. Dessa forma, cada hidrogênio compartilha 1 elétron com o oxigênio. Assim, pela representação de Lewis, teremos.
Importante ressaltar que a formação de um composto pode ser dada por um conjunto de ligações iônicas e covalentes, ou seja, as ligações interatômicas serem parcialmente iônicas e parcialmente covalentes em um mesmo material. E, realmente, são poucos os compostos que exibem ligações exclusivamente iônicas ou covalentes. O grau de cada tipo de ligação está associado à posição relativa de seus átomos constituintes na tabela periódica ou da diferença de suas eletronegatividades. O caráter iônico de uma ligação pode ser calculado por (1), obtendo a quantidade iônica de uma ligação entre dois elementos A e B, sendo A o elemento mais eletronegativo, com XA e XB as eletronegatividades dos respectivos elementos.
Por fim, nas ligações primárias, a ligação que ocorre entre elementos metálicos é denominada ligação metálica. Nesse tipo de ligação, há formação dos compostos metálicos e suas ligas. Nesse modelo, os elétrons de valência não estão ligados a nenhum átomo em particular no sólido e estão mais ou menos livres para se movimentar ao longo de todo o metal. Eles podem ser considerados como pertencentes ao metal como um todo, como se formassem um mar de elétrons. Devido a essa característica, os materiais metálicos são ótimos condutores de energia.
As ligações secundárias, mais fracas quando comparadas com as primárias, são chamadas de interações ou forças intermoleculares, ou simplesmente ligações de van der Waals. Nessas ligações não há doação ou compartilhamento dos elétrons de valência, mas normalmente são formadas quando ocorre uma distribuição de cargas desigual, criando um dipolo, de carga total zero, com uma das extremidades com carga positiva ou negativa em relação a outra extremidade. Esses dipolos podem ser produzidos por uma flutuação aleatória dos elétrons em torno do que é normalmente um campo elétrico simétrico no átomo.
Identificando os elementos químicos que constituem um composto, bem como a ligação química que os mantém unidos, é possível obter propriedades físicas, químicas e mecânicas oriundas do tipo de ligação existente. Por exemplo:
- Compostos iônicos apresentam boa resistência mecânica, altos pontos de fusão e ebulição, normalmente são isolantes e apresentam aspecto cristalino.
- Compostos covalentes são bons isolantes térmicos e elétricos, baixos pontos de fusão e ebulição quando comparados aos compostos iônicos e metálicos e possuem solubilidade variada.
- Compostos metálicos são bons condutores de calor e eletricidade ponto de fusão e ebulição elevados, apresentam maleabilidade e ductilidade e possuem brilho característico.
Esses conceitos são fundamentais para a seleção correta de materiais segundo as especificações de utilização requeridas.
Além disso, é importante compreender que a matéria pode ser obtida, basicamente, em três estados físicos: sólido, líquido e gasoso. O estado em que a matéria se encontra depende, em condições ideais, da temperatura em que se encontra. Nesse caso, para um composto, o estado gasoso terá maior temperatura que o estado líquido, que por sua vez, terá maior temperatura que o estado sólido.
As mudanças de fase recebem o nome de:
- Fusão: quando ocorre a mudança do estado sólido para o estado líquido.
- Vaporização: quando ocorre a mudança do estado líquido para o estado gasoso.
- Condensação: quando ocorre a mudança do estado gasoso para o estado líquido.
- Solidificação: quando ocorre mudança do estado líquido para o estado sólido.
- Sublimação: quando ocorre a mudança do estado sólido para o estado gasoso e vice-versa.
Contudo, em condições não ideais, a variação e/ou mudança de estado de uma substância pode ocorrer através da variação das propriedades pressão (p), volume (V) e temperatura (T).
Saber identificar o estado físico que uma matéria pode apresentar sobas condições fornecidas de um projeto, por exemplo, é fundamental para a escolha correta do material que será utilizado, garantindo as condições de segurança e custo-benefício. Por exemplo, em uma área em que há perigo de incêndio, os materiais que constituem a estrutura principal devem suportar altas temperaturas, caso ocorra o incidente, evitando dano material e/ou estrutural.
É Hora de Praticar!
Olá, Estudante! Nesse estudo de caso imagine que você é trainee de uma empresa que desenvolve projetos em diversas áreas através da aplicação de novas tecnologias. Essa empresa é conhecida no mercado nacional por propor soluções inteligentes e práticas para os projetos, visando a sustentabilidade e o custo-benefício.
Recentemente, um novo projeto começou a ser dimensionado, algo relacionado à produção de materiais utilizando alumínio. Preocupado com o meio ambiente, visando a sustentabilidade do projeto, o coordenador solicitou a você que desenvolvesse uma pesquisa sobre a obtenção do alumínio metálico.
Foi informado que, para produzir alumínio metálico, utiliza-se a bauxita como matéria-prima. E após a refinação da bauxita é obtida a alumina ou óxido de alumínio (Al2O3). Próxima etapa, é a reação da alumina com carbono, para formação do alumínio metálico, num processo de redução por eletrólise, dada por:
Assim, em sua pesquisa sobre a obtenção do alumínio metálico, deve ser levando em consideração as propriedades e características dos elementos envolvidos na obtenção produto. E ainda, identificar as ligações químicas presentes nos reagentes e produtos envolvidos no processo da fabricação do alumínio metálico.
Bons estudos!
Reflita
Existem 118 elementos químicos que constituem e formam toda e qualquer matéria conhecida pelo homem até hoje. Pelas expectativas científicas, é possível a descoberta de novos elementos químicos, seja natural ou sintético? Por quê?
É possível modificar propriedades específicas de um composto iônico para adequar a uma aplicação? Se sim, como?
Os materiais metálicos podem ser encontrados no estado gasoso? Como?
Resolução do estudo de caso
Retomando ao estudo de caso, você atua como trainee em uma empresa que desenvolve projetos em diversos projetos visando tecnologia alinhada com a sustentabilidade. No desenvolvimento de um novo projeto, você ficou responsável por desenvolver uma pesquisa sobre a obtenção do alumínio metálico.
Foi informado que, para produzir alumínio metálico, utiliza-se a bauxita como matéria-prima. E após a refinação da bauxita é obtida a alumina ou óxido de alumínio (Al2O3). Próxima etapa, é a reação da alumina com carbono, para formação do alumínio metálico, num processo de redução por eletrólise, dada por:
A pesquisa deve conter informações sobre a obtenção do alumínio metálico, levando em consideração as propriedades e características dos elementos envolvidos na obtenção produto. E ainda, identificar as ligações químicas presentes nos reagentes e produtos envolvidos no processo da fabricação do alumínio metálico.
Para a resolução desse estudo de caso, será necessário conhecer e compreender os conceitos básicos sobre átomos, ligações químicas e estados da matéria, para identificar as características e propriedades do material obtido.
Após o processo de mineração e refino da bauxita, é obtido o composto oxido de alumínio, também conhecido como alumina (Al2O3). Esse composto é formado por dois elementos químicos: alumínio (metal) e oxigênio (não metal).
O alumínio é um elemento químico pertencente à família 3A da tabela periódica, de número atômico igual a 13. Por sua alocação na tabela, é o metal e apresenta 3 elétrons de valência. Essa informação pode ser confirmada através da distribuição eletrônica, considerando que o átomo neutro possua 13 prótons e 13 elétrons. A distribuição eletrônica para o alumínio será 1s22s22p63s23p1 Assim, vemos que a camada 3 é a última preenchida (camada de valência), contendo 3 elétrons (elétrons de valência).
Já o oxigênio é um elemento químico pertencente à família 6A da tabela periódica, de número atômico igual a 8. Por sua alocação na tabela, é o ametal e apresenta 6 elétrons de valência. Essa informação pode ser confirmada através da distribuição eletrônica, considerando que o átomo neutro possua 8 prótons e 8 elétrons. A distribuição eletrônica para o oxigênio será 1s22s22p4. Assim, vemos que a camada 2 é a última preenchida (camada de valência), contendo 6 elétrons (elétrons de valência).
Assim, a alumina é um composto químico formado entre um elemento metálico e um não metálico. Para que a ligação química ocorra, os elétrons do alumínio serão doados ao oxigênio, assim haverá a formação dos íons cátion Al+3 e ânion O-2. Dessa forma, a ligação química presente será ligação iônica. E, pela representação de Lewis, teremos:
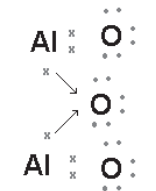
A próxima etapa para a obtenção do alumínio metálico, há a reação do óxido de alumínio com o carbono, a partir de um processo de redução por eletrólise. Para que esse processo ocorra, o alumínio se dissocia do oxigênio e seus átomos reagem entre si. Como são íons metálicos (Al3+), então se unem através de ligações metálicas, formando o material alumínio.
Com os elementos carbono e oxigênio, há a formação do dióxido de carbono. Tanto oxigênio quando carbono são elementos não metálicos. Logo, a ligação química presente nesse composto será covalente.
O carbono é um elemento químico pertencente à família 4A da tabela periódica, de número atômico igual a 6. Por sua alocação na tabela, é o ametal e apresenta 4 elétrons de valência. Essa informação pode ser confirmada através da distribuição eletrônica, considerando que o átomo neutro possua 6 prótons e 6 elétrons. A distribuição eletrônica para o carbono será 1s22s22p2. Assim, vemos que a camada 2 é a última preenchida (camada de valência), contendo 4 elétrons (elétrons de valência).
Assim, para a reação do dióxido de carbono, teremos duas ligações covalentes duplas para que uma molécula seja formada. Pela representação de Lewis:
Analisando o produto da reação para obtenção do alumínio metálico, vemos que há liberação de gás carbônico, poluente e causador do efeito estufa. Como o projeto prevê a sustentabilidade, alguma ação deve ser desenvolvida para reverter os danos que o CO2 liberado causará no meio ambiente.
Dê o play!
Assimile
Olá, estudante! No mapa mental abaixo você verá os principais assuntos relacionados à estrutura da matéria. Importante conhecer cada definição para poder realizar as aplicações necessárias em estudos relacionados à formação e constituição da matéria.
Referências
ASKELAND, Donald R.; WRIGHT, Wendelin J. Ciência e engenharia dos materiais – Tradução da 4a edição norte-americana. São Paulo: Cengage Learning Brasil, 2019. E-book. ISBN 9788522128129. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788522128129/. Acesso em: 02 mar. 2024.
ATKINS, Peter. Físico-Química - Fundamentos, 6ª edição. Rio de Janeiro: Grupo GEN, 2017. E-book. ISBN 9788521634577. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521634577/. Acesso em: 03 mar. 2024.
JR., William D C. Ciência e Engenharia de Materiais - Uma Introdução. Rio de Janeiro: Grupo GEN, 2020. E-book. ISBN 9788521637325. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521637325/. Acesso em: 02 mar. 2024.
KOTZ, John C.; TREICHEL, Paul M.; TOWNSEND, John R.; ET.AL. Química Geral e Reações Químicas v.1. São Paulo: Cengage Learning Brasil, 2023. E-book. ISBN 9786555584516. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9786555584516/. Acesso em: 03 mar. 2024.
NEWELL, James. Fundamentos da Moderna Engenharia e Ciência dos Materiais. Rio de Janeiro: Grupo GEN, 2010. E-book. ISBN 978-85-216-2490-5. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/978-85-216-2490-5/. Acesso em: 02 mar. 2024.
SMITH, William F.; HASHEMI, Javad. Fundamentos de Engenharia e Ciência dos Materiais. Porto Alegre: Grupo A, 2012. E-book. ISBN 9788580551150. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788580551150/. Acesso em: 02 mar. 2024.