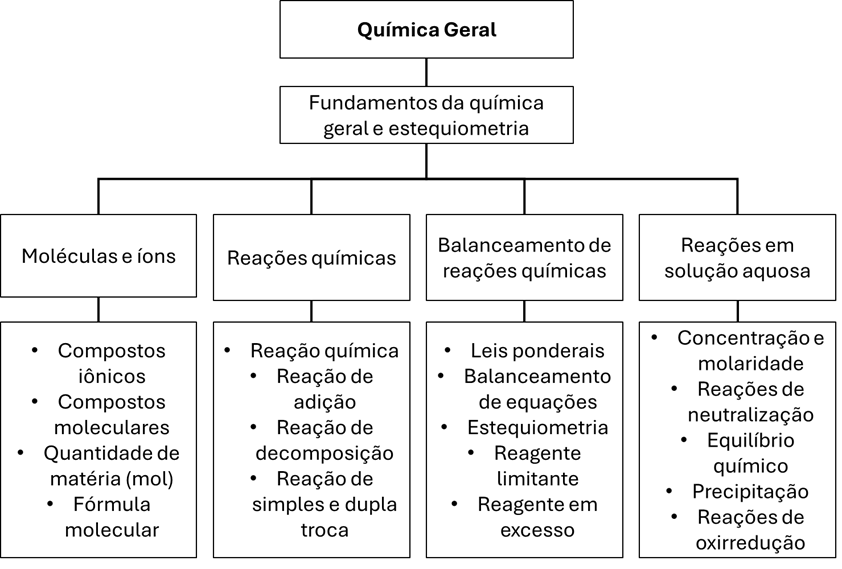
Fundamentos da Química Geral e Estequiometria
Aula 1
Moléculas e Íons
Moléculas e íons
Olá, estudante! Nesta videoaula você irá conhecer os compostos iônicos e moleculares, o conceito de quantidade de matéria e a determinação da fórmula de compostos. Esses conteúdos são importantes para a sua prática profissional, pois são cruciais e aplicáveis em diversas áreas profissionais. Guiam a síntese de substâncias, influenciam a produção industrial, possibilitam a formulação precisa de reações químicas, e são fundamentais em setores como química, farmacologia e engenharia, contribuindo para avanços científicos e tecnológicos. Esteja pronto para embarcar nesta jornada de aprendizado! Vamos lá!
Ponto de Partida
Caro estudante! Ao trabalhar com análise de amostras, como o conceito de mol é aplicado para determinar a concentração de uma substância específica? Ou em pesquisas farmacêuticas, como a compreensão das ligações iônicas e covalentes contribui para o design de novos medicamentos? No campo da nanotecnologia, como a compreensão das ligações e fórmulas moleculares é aplicada na síntese de novos materiais? Ou na área de pesquisa espacial, como os conceitos de quantidade de matéria são aplicados para entender a composição de corpos celestes?
Nesta aula você compreenderá a estrutura de compostos iônicos e moleculares, sabendo diferenciar os diferentes tipos de substâncias químicas. Você conhecerá o conceito de quantidade de matéria e saberá aplicar esse conceito na resolução de problemas. Por fim, aprenderá a determinar a fórmula de substâncias químicas, sendo esse procedimento essencial para desenvolver novos materiais e para elucidar a estrutura de compostos químicos.
Pensando nisso, temos como ponto de partido o titânio. Ele é o nono elemento mais abundante na terra, sendo bastante aplicado na obtenção de ligas metálicas devido às suas características de leveza e resistência térmica, sendo bastante empregado na aeronáutica. O principal processo industrial para obtenção do titânio a partir de minerais é o processo Kroll, que consiste em duas etapas:
Como responsável pelo processo de obtenção, você precisa saber o que esperar deste processo, ou seja, quanto de titânio puro você obtém a partir de determinada quantia de mineral. Supondo que não há perdas no processo e que toda ilmenita é convertida em titânio sólido, qual a massa de titânio obtida a partir de 345g de mineral? Quanto de carbono é utilizado na reação?
Então, desperte a curiosidade, pois cada página é uma descoberta e cada conceito é um passo em direção ao seu potencial ilimitado. Bons estudos!
Vamos Começar!
Caro estudante, os átomos se conectam através de ligações químicas que podem ser iônicas, covalentes ou metálicas. Dependendo do tipo de ligação, os compostos terão características e propriedades diferentes.
Compostos iônicos não são moléculas, ou seja, não são pares ânions-cátions isolados, mas, sim, íons arranjados em um retículo tridimensional, sendo que cada um está em contato com mais de um vizinho. A estrutura de cada retículo depende da carga dos íons e de seus tamanhos. Embora o seja representado como molécula, precisamos saber que esta é apenas a proporção entre e no retículo (Figura 2.1).
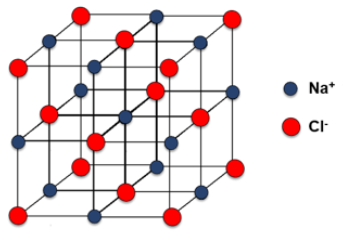
A formação destes retículos aumenta a estabilidade das espécies formadas na ligação iônica. Podemos dizer que a formação do retículo cristalino libera energia para o meio ao ser formado, sendo que quanto maior este valor, mais estável o retículo é e mais fácil ocorre a sua formação. Compostos iônicos possuem como características serem duros e quebradiços, o que podemos explicar devido à interação de cargas. A dureza se dá pela interação entre cargas negativas e positivas, porém, ao aplicarmos pressão em um retículo cristalino, ocorre o deslizamento entre camadas, levando à interação entre cargas de mesmo sinal, que se repelem, resultando na quebra.
Outras características dos compostos iônicos dizem respeito a elevados pontos de fusão e ebulição, uma vez que a atração entre íons no retículo é grande, sendo necessária mais energia para romper as ligações interiônicas. Compostos iônicos são péssimos condutores de eletricidade devido à sua estrutura rígida, que não permite o movimento de elétrons. A solubilidade de compostos iônicos em água é grande, o que pode ser explicado pela interação de cátions com a densidade de carga () negativa da água (sobre o átomo de oxigênio) e de ânions, com a densidade de carga positiva da água (sobre os átomos de hidrogênio), como representado na Figura 2.2.
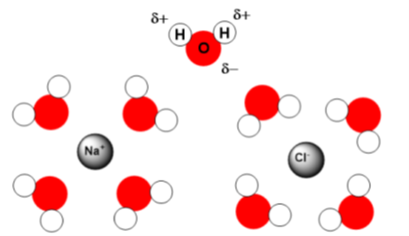
A água que solubiliza os íons de compostos iônicos, como visto na unidade anterior, é um composto molecular, formado por ligações covalentes. Estes compostos são representados por fórmulas moleculares, sendo a molécula a menor parte identificável de uma substância pura, ou uma substância complexa, como a glicose ou a água . Precisamos tomar cuidado quando falamos em fórmula condensada, pois algumas fórmulas podem descrever compostos bem diferentes em termos de propriedades, como que descreve tanto o etanol, quanto o éter dimetílico (Figura 2.3).

Nas moléculas covalentes, o tamanho das ligações entre os átomos depende de uma série de fatores, como o tamanho dos átomos e o tipo de ligação. Você lembra que o raio atômico é medido como a distância entre os núcleos dos átomos da ligação? Então, quanto maior o raio atômico, maior a ligação. Podemos observar isso claramente nas ligações entre halogênios (representados por X) e hidrogênio. O flúor é o elemento que apresenta o menor raio atômico, portanto, o menor átomo, assim a ligação é a menor, já o iodo é o maior átomo, logo é a maior ligação. O tamanho das ligações é . O comprimento de ligação é importante na determinação do tamanho total e da forma de uma molécula.
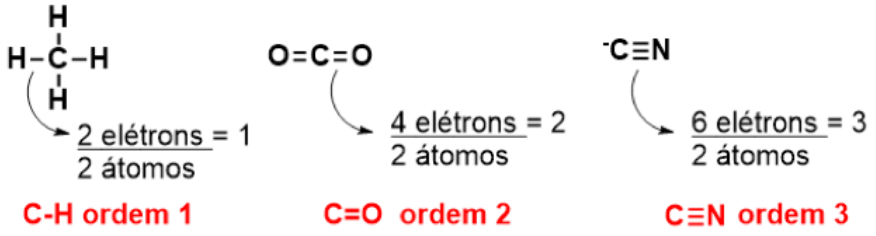
Quando falamos de estruturas de Lewis, vimos que algumas ligações eram simples (com apenas um par de elétrons compartilhados), duplas ou triplas. Estas últimas, com dois pares de elétrons e três pares, respectivamente. Assim, chamamos de ordem da ligação o número de pares de elétrons que é compartilhado em uma ligação por dois átomos, como vemos na Figura 2.4.
Siga em Frente...
Como foi mencionado, o tamanho da ligação sofre influência da ordem da ligação, sendo que quanto maior a ordem da ligação, menor o tamanho da ligação. A ligação simples carbono-oxigênio tem tamanho de (picômetro), a ligação dupla carbono-oxigênio e a ligação tripla .
Outra característica importante de compostos covalentes é que a ligação possui uma energia que é absorvida ou liberada quando a rompemos. Esta energia é chamada de energia de dissociação de ligação () e ocorre quando os reagentes e produtos estão em fase gasosa. Quando a energia é fornecida ao sistema, temos um valor positivo e quanto mais positivo o valor, mais forte é a ligação que se rompeu. Se observarmos a quebra das ligações carbono-carbono, veremos que a ligação tripla é mais estável que a dupla, que é mais estável que a simples (KOTZ et al, 2014, p. 369):
Sobre as propriedades físicas, os compostos moleculares mais simples são comumente gases ou líquidos, sendo sólidos apenas em estruturas maiores, como a mencionada glicose . Quando falamos em moléculas e compostos iônicos, como podemos nos referir às quantidades? Quando você vai ao supermercado, você compra ovos em dúzias, não é? Dúzia é uma unidade de medida que corresponde a 12 unidades de ovos. Para moléculas, utilizamos o mol, que corresponde a moléculas. Se você compra um pacote de 12 latas de refrigerantes e pesa, você determina o peso de uma dúzia de refrigerantes.
Assim, 1 mol de átomos, moléculas ou íons, corresponde a átomos, moléculas ou íons. O número de íons, moléculas ou átomos por mol, , é chamado de constante de Avogadro (), em homenagem a Lorenzo Romano Amedeo Carlo Avogadro, que no século XIX estudou o átomo. Lembre-se de que por ser uma unidade de medida, o mol pode ser usado com prefixos, sendo mmol = mol e mol.
Como não é possível contarmos os átomos diretamente com facilidade, para sabermos quantos átomos existem em uma determinada massa de amostra, precisamos apenas saber a massa molar () e o número de mols. Sendo que a massa molar de um elemento (em gramas) é a quantidade de massa por mol de seus átomos, numericamente igual à massa atômica em unidades de massa atômica: 1 mol de magnésio possui massa molar de 24,3g, 1 mol de carbono possui massa molar de 12g, 1 mol de silício possui massa molar de 28,09g.
Quando falamos em mols, podemos fazer uma relação entre componentes que levam à formação de uma molécula, por exemplo, o metano, constituído de átomos de carbono e hidrogênio (KOTZ et al, 2014, p. 99):

Se voltarmos para a molécula de glicose , é possível você calcular a massa de carbono, hidrogênio e oxigênio em 1 mol de glicose. Basta usar as relações que já conhecemos, envolvendo mol e a relação recém-apresentada, que nos diz que 1 mol de glicose é obtido a partir de 6 mols de carbono:
Aplicando a mesma relação para e , temos que a massa de hidrogênio é 12g e de oxigênio 96g, ambas em 1 mol de glicose.
A composição molecular pode ser apresentada de três maneiras: 1) número de átomos de cada tipo por molécula (ou unidade-fórmula), que é a fórmula do composto; 2) termos de massa de cada elemento por mol do composto, como calculamos para o carbono, hidrogênio e oxigênio; 3) termos de porcentagem em massa.
A porcentagem em massa consiste enquanto da massa total temos de massa do elemento. Sabendo que a massa da glicose é de temos:
Repetindo o cálculo, temos a porcentagem em massa para o hidrogênio e o oxigênio de e , respectivamente.
O cálculo inverso também pode ser realizado, sabendo a porcentagem em massa de cada elemento, podemos chegar à fórmula molecular (ou unidade-fórmula) de um composto, basta sabermos a sua massa.
Exemplificando
A análise de espectrometria de massas de um determinado composto determinou sua massa molecular como sendo . Já a análise elementar deste composto apresentou de carbono, de hidrogênio e de oxigênio. Para sabermos a fórmula molecular, precisamos verificar quanto de massa corresponde a cada uma destas porcentagens (Figura 2.5).

A proporção de átomos é 13 mols de carbono, para 18 mols de H e 2 mols de oxigênio. Como esta é a menor proporção possível mantendo os números inteiros, temos que a fórmula molecular é . Esta fórmula pode corresponder ao composto ibuprofeno, molécula bioativa com ação anti-inflamatória.
Vamos Exercitar?
Estudante, o entendimento da composição e divisão da matéria em compostos iônicos e moleculares, assim como o conceito de mol (quantidade de matéria) e a determinação de fórmula química são importantes para compreender o comportamento de diferentes materiais, assim como o desenvolvimento de novos materiais.
Assim, para mapear o processo de obtenção de titânio, você pode adotar duas abordagens:
1) A partir do mol: você sabe que 1 mol de tem massa molar de 151,8g , então 345g correspondem a 2,27 mols de moléculas de (regra de 3).
Se 1 mol de leva a 1 mol de , ao reagirmos 2,27 mols de minério, vamos obter a mesma quantidade de em mols, portanto 2,27 mols.
2) A partir da massa: basta você utilizar as massas molares calculadas:
O segundo ponto de mapeamento do processo é saber quanto de carbono é utilizado. Vamos resolver esta questão utilizando o conceito de mol: 1 mol de reage com 6 mols de carbono, sendo que 345 g de correspondem a 2,27 mol, devemos consumir 6 vezes esta quantia de carbono mols de C.
Você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre o conceito de mol e a determinação de fórmulas químicas, acesse a biblioteca virtual e faça a leitura do capítulo 3, Reações Químicas e estequiometria de reação, do livro “Química: a ciência central, disponível na biblioteca virtual [Biblioteca Virtual 3.0].
BROWN, T. L. et al. Química: a ciência central. 1. ed. São Paulo, SP: Pearson, 2016. E-book. Disponível em: https://plataforma.bvirtual.com.br. Acesso em: 05 fev. 2024.
Para compreender e aprofundar seus conhecimentos sobre quantidade de matéria e sobre o mol, faça a leitura do artigo: “Quantidade de substância”, disponível em: https://doi.org/10.20396/chemkeys.v0i9.9659. Acesso em: 05 fev. 2024.
Por fim, você pode aprender mais sobre a construção de moléculas lendo o material e realizando simulações por meio da página “Build a Molecule”. Utilize a ferramenta de tradução de seu navegador caso tenha dificuldade com o idioma Inglês. Disponível em: https://phet.colorado.edu/en/simulation/legacy/build-a-molecule. Acesso em: 05 fev. 2024.
Referências Bibliográficas
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
KOTZ, J. C. et al. Química geral e reações químicas.2. ed. v. 1. São Paulo: Cengage Learning, 2014.
Aula 2
Reações Químicas
Reações Químicas
Olá, estudante! Nesta videoaula você irá conhecer as transformações da matéria, para isso, você precisa compreender as equações químicas e conhecer os principais tipos de reações, como as reações de adição, de decomposição, de simples troca e de dupla troca. Esse conteúdo é importante para a sua prática profissional, pois é essencial para compreender e controlar processos industriais, reações químicas e fenômenos naturais, além de prever resultados, otimizar processos e contribuir para avanços em diversas áreas, desde a indústria até a pesquisa científica. Preparado para embarcar nessa jornada de aprendizado? Vamos lá, então!
Ponto de Partida
Olá, estudante! Segundo Russel (2011), as transformações químicas são mais significativas ou fundamentais do que as transformações físicas. Nestas transformações, algumas substâncias são transformadas e outras são formadas. Um exemplo é a exposição de um prego de ferro ao ar livre e à chuva, que causa uma transformação química, porque o ferro é combinado quimicamente ao oxigênio e à água da atmosfera, formando a ferrugem. As transformações químicas são denominadas reações químicas. As substâncias que se transformam durante as reações são chamadas de reagentes, enquanto as que são formadas são chamadas de produtos.
Nessa aula você aprenderá a classificar as reações químicas. As reações químicas podem ser classificadas perante a sua velocidade, aquecimento, reversibilidade, mas, principalmente, pelas suas substâncias participantes, ou seja, pelos reagentes e produtos envolvidos na reação. Dentro dessa classificação temos quatro tipos de reações, são elas: as reações de síntese ou adição, as reações de decomposição ou análise, as reações de simples troca ou deslocamento e as reações de dupla troca.
Para aplicação desses conceitos, agora vamos pensar nos diferentes processos de tratamentos de água, iniciando pelo tratamento mais básico e fundamental pertencente ao nosso cotidiano, o tratamento de água para que ela se torne apropriada para o nosso consumo. A água que chega às nossas torneiras é retirada da represa através de bombeamento e segue para a Estação de Tratamento de Água, também conhecida pela sigla ETA. Nessa estação, a água passa por alguns estágios de tratamento, que são: a floculação, a decantação e a filtração para que chegue em sua casa limpa e sem oferecer riscos à sua saúde. Mas, onde estão as reações químicas nesse processo de tratamento? Na floculação! Para que ela ocorra, são adicionados reagentes e ocorrem reações químicas que irão retirar as impurezas da água, tornando-a límpida. E quais são eles?
Com os conhecimentos adquiridos você deverá identificar quais são os reagentes adicionados a água para que ocorra o processo de floculação, bem como as reações químicas envolvidas nesse processo e classificá-las. Bons estudos e vamos em frente!
Vamos Começar!
Uma reação química é um processo de transformação química causado pela produção ou quebra de ligações. As reações ocorrem quando átomos ou moléculas se chocam entre si da maneira correta e com energia suficiente para possibilitar a quebra de ligações existentes ou a formação de novas ligações. Durante uma reação química, os átomos se rearranjam em novas combinações e, assim, as substâncias são formadas. O mesmo composto pode ser formado por reações químicas diferentes, mas independentemente de como um composto particular é produzido, sua composição é sempre a mesma.
As reações químicas podem ser representadas pelas equações químicas usando as fórmulas moleculares das substâncias envolvidas na reação, a equação representa a transformação química que está ocorrendo. As substâncias iniciais, ou reagentes, são separadas das substâncias formadas na reação - os produtos, por uma seta, a qual mostra a direção da transformação química que está ocorrendo, apontando dos reagentes para os produtos. Quando mais de uma substância aparece do mesmo lado da seta, elas são separadas por um sinal de soma (), como na reação de formação do sulfato de cobre:
A reação de formação do sulfato de cobre pode ser lida de várias maneiras, como: o óxido de cobre e o ácido sulfúrico são consumidos para formar o sulfato de cobre e água, ou o óxido de cobre e o ácido sulfúrico reagem para formar o sulfato de cobre e água, ou ainda, o óxido de cobre e o ácido sulfúrico produzem o sulfato de cobre e água.
Alguns símbolos podem ser utilizados nas equações químicas para representar os fenômenos que estão ocorrendo na reação, como mostra a Tabela 2.1.
Símbolo | Significado |
| Indica que está sendo fornecido calor à reação. |
Indica que a reação ocorre em fase aquosa (em água). | |
Indica a presença de catalisador na reação. | |
Indica a presença de energia luminosa. | |
Indica que uma substância reage com outra. | |
Aponta o sentido que a reação está ocorrendo. | |
Indica que a reação é reversível, ou seja, ocorre nos dois sentidos. | |
Indica liberação de gás. | |
Indica precipitação de sólido. | |
Substância em estado sólido. | |
Substância em estado líquido. | |
Substância em estado gasoso. |
Tabela 2.1 Símbolos usados nas equações químicas. Fonte: FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
Um exemplo da simbologia utilizada em equações químicas é observado na equação que representa a produção do mercúrio metálico:
Observa-se que o óxido de mercúrio em estado sólido se decompõe por aquecimento, produzindo o mercúrio metálico em estado líquido e liberando gás oxigênio.
As reações químicas podem ser classificadas conforme a sua velocidade, aquecimento, reversibilidade e substâncias participantes. A velocidade de uma reação química descreve a rapidez com que uma transformação química ocorre, é medida experimentalmente em função do consumo dos reagentes e a formação dos produtos, sendo classificada como lenta, intermediária ou rápida. A velocidade de uma reação química dependerá da natureza das ligações químicas, das moléculas nas quais essas ligações estão localizadas, da concentração dos reagentes e da temperatura. Quanto maior a concentração dos reagentes maior será o número de colisões entre as moléculas e, consequentemente, mais rápida a reação será. E, quanto maior a temperatura, maior será a energia interna das moléculas, aumentando o número de colisões. Outro fator que influencia na velocidade das reações químicas é a adição de catalisadores, substâncias que aumentam a velocidade de uma reação química sem serem consumidos por ela.
As reações químicas também podem ser classificadas perante a sua absorção ou liberação de calor. A maioria das reações químicas envolvem transformações de energia térmica. Energia térmica é a forma de energia relacionada com a temperatura e é transferida sob forma de calor. Se o calor é liberado durante a reação, esta é chamada exotérmica. Se o calor é absorvido, a reação é chamada de endotérmica. Outro modo de classificar as reações químicas é conforme a sua reversibilidade. Reações irreversíveis são aquelas que pelo menos um dos reagentes é consumido totalmente até o final da reação, a reação ocorre em um único sentido, ou seja, os produtos não voltarão a formar os reagentes da reação. As reações irreversíveis são representadas por uma seta simples (→). As reações reversíveis são aquelas que se deslocam para os dois sentidos, ou seja, os reagentes são consumidos, formando os produtos e os produtos são consumidos, formando os reagentes novamente, até que a reação atinja um equilíbrio químico.
Siga em Frente...
A principal classificação das reações químicas é segundo as substâncias participantes, ou seja, reagentes e produtos envolvidos na reação. A maioria das reações pode ser classificada em:
Reações de síntese ou adição, nas quais dois ou mais reagentes se combinam para formar um produto, como mostra a equação a seguir.
Podemos observar que a reação possui dois reagentes (A e B) que reagem e produzem um único produto (AB). A síntese do óxido de magnésio é um exemplo dessa classificação de reação química:
Observa-se que os reagentes () formam o produto óxido de magnésio ().
Reações de análise ou decomposição são as que consistem na quebra de um composto em compostos mais simples ou elementos químicos. Compostos binários simples (compostos de dois elementos) podem ser decompostos em seus elementos. Essa decomposição pode ocorrer através de um aquecimento (pirólise), da passagem de corrente elétrica pela substância fundida ou em meio aquoso (eletrólise), ou na presença de luz (fotólise). Um exemplo dessa classificação é a reação que ocorre nos airbags dos automóveis, que é a decomposição do trinitreto de sódio quando aquecido, representada pela seguinte equação química:
Pode-se observar que o trinitreto de sódio se decompõe formando gás nitrogênio e sódio metálico. A equação a seguir apresenta a formulação dessa reação, em que é possível verificar que um composto químico (AB) se decompõe formando duas substâncias diferentes (A e B).
Reações de simples troca ou deslocamento são as quais um elemento ocupa o lugar de outro num composto. Por exemplo, se jogarmos uma moeda de cobre em água contendo nitrato de prata, , a moeda fica coberta com prata brilhante. O cobre substitui a prata na reação:
A equação a seguir apresenta essa reação em que é possível observar que os dois reagentes (A e BC) reagem entre si formando dois produtos (AC e B), sendo que os íons A e B realizaram uma troca de posição na reação química.
Reações de dupla troca são as quais dois reagentes trocam íons para formar dois novos compostos. A equação a seguir mostra o esquema dessa reação, quando é possível verificar que os dois reagentes, AD e BC, produzem duas outras substâncias, AC e BD, em que os íons D e C realizam uma dupla troca de posições.
Essas reações continuam a ocorrer até que um ou mais reagentes sejam primeiramente consumidos. Para uma reação se completar, um dos produtos deve ser eliminado dela. Um exemplo desse tipo de reação é a formação do sulfato de bário:
O sulfato de cobre e o cloreto de bário são consumidos, formando o sulfato de bário e o cloreto de sódio. Observa-se que os cátions das reações realizaram a dupla troca, formando os dois produtos.
Reações de combustão envolvem a queima de um combustível na presença de oxigênio, levando à formação de um composto contendo oxigênio (para o octano temos o gás carbônico) e água.
Vamos Exercitar?
Estudante, conhecer e compreender as reações químicas é fundamental para trabalhar com as transformações da matéria e com a obtenção de diferentes tipos de produtos. As reações químicas podem ser classificadas de diferentes formas, entre elas, por meio dos reagentes e produtos envolvidos.
Sobre o exposto, vamos retornar a questão do tratamento de água. A água é um recurso natural muito precioso para nós e é utilizada para os mais diversos fins, porém, antes que chegue às nossas casas, precisa passar por um tratamento com a finalidade de retirar as impurezas nela existentes para que não cause danos à nossa saúde. Esse tratamento é composto por processos físicos e químicos, sendo que o processo químico envolvido é a floculação, que é a formação de agregados de partículas finas em suspensão no líquido, que são chamados de flocos ou floculados. A aplicação desse processo tem como objetivo que esses flocos arrastem a sujeira presente na água para o fundo do tanque num processo de decantação e, assim, a água fique clarificada, ou seja, límpida.
Quando a água chega na estação de tratamento de água (ETA) são adicionados óxido de cálcio (). O cloro possui a função de desinfectar a água, já o óxido de cálcio e o sulfato de alumínio são os reagentes que darão sequência ao processo de floculação da seguinte forma:
Primeiramente, o óxido de cálcio (cal) é adicionado à água, reagindo com ela e formando o hidróxido de cálcio (), da seguinte forma:
Essa reação química pode ser classificada como uma reação de síntese ou adição, já que as duas substâncias, óxido de cálcio e água, reagem e formam uma única substância, o hidróxido de cálcio.
Para dar continuidade ao processo de floculação é necessária a adição de um agente floculante. No Brasil, o sulfato de alumínio () é o mais utilizado e é produzido através da reação química entre o óxido de alumínio () e o ácido sulfúrico (). O sulfato de alumínio é adicionado à água, que já contêm hidróxido de cálcio, formando uma substância gelatinosa, o hidróxido de alumínio (), conforme a seguinte reação química:
Já essa reação química, podemos concluir que é de dupla troca, quando as duas substâncias, sulfato de alumínio e hidróxido de cálcio, reagem formando outras duas substâncias, o sulfato de cálcio e o hidróxido de alumínio.
Assim, as partículas de sujeira que estão na água vinda da represa se aglutinam e ficam agregadas no hidróxido de alumínio, formando flocos sólidos que posteriormente decantam no fundo dos tanques da ETA.
Com isso, você conseguiu avaliar o sistema de tratamento de água e como as reações são classificadas neste processo. Além disso, você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre as reações químicas e as suas classificações, acesse a biblioteca virtual e faça a leitura do capítulo 4, Reações Químicas, do livro “Introdução à química geral”, disponível na Minha Biblioteca.
BETTELHEIM, Frederick A.; BROWN, William H.; CAMPBELL, Mary K.; FARRELL, Shawn O. Introdução à química geral. São Paulo: Cengage Learning Brasil, 2016. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788522126354/. Acesso em: 25 jan. 2024.
Para compreender e aprofundar seus conhecimentos sobre reações químicas, faça a leitura do artigo: “Abordagem de reações químicas: uso do simulador PhET”, disponível em: https://scientia-amazonia.org/wp-content/uploads/2016/09/v5-n2-72-76-2016.pdf. Acesso em: 05 fev. 2024.
Por fim, aprofunde seus conhecimentos sobre a aplicação das reações químicas por meio da leitura e estudo do artigo “Experimentação alternativa no ensino e aprendizagem de reações químicas”, disponível em: https://www.editorarealize.com.br/editora/anais/conapesc/2019/TRABALHO_EV126_MD1_SA3_ID462_16072019193142.pdf. Acesso em: 05 fev. 2024.
Referências Bibliográficas
FÁBREGA, F. M.. Química Geral e Experimental. Londrina: Editora e Distribuidora S.A., 2016.
KOTZ, J. C. et al. Química geral e reações químicas. 2. ed. São Paulo: Cengage Learning, 2014. v. 1.
RUSSEL, John B. Química geral. v. 2, 2. ed. São Paulo: Pearson Education do Brasil, 2011.
Aula 3
Balanceamento de Reações Químicas
Balanceamento de Reações Químicas
Olá, estudante! Nesta videoaula você irá conhecer os processos e etapas para balancear uma equação química, assim como compreender os princípios dos procedimentos estequiométricos, determinando o reagente limitante e em excesso de uma reação. Esse conteúdo é importante para a sua prática profissional, pois ele permite otimizar processos de produção, garantir a eficiência e a qualidade dos produtos, minimizar desperdícios de reagentes e maximizar rendimentos, além de contribuir para a segurança e a sustentabilidade dos processos industriais. Esteja preparado para embarcar nesta jornada de aprendizado! Vamos lá!
Ponto de Partida
Olá, estudante! Nesta aula vamos estudar o balanceamento das equações químicas. Toda equação química deve estar devidamente balanceada para que obedeça a Lei de Lavoisier, a qual postula que a soma das massas dos reagentes é igual à soma das massas dos produtos. Existem diversos métodos para se balancear uma equação química, porém o mais utilizado é denominado método das tentativas por ser bastante simples de ser aplicado e muito eficiente. Além disso, vamos trabalhar com as relações estequiométricas e determinar o reagente limitante e o reagente em excesso de uma reação química. Por fim, você vai calcular o rendimento real de uma reação química.
Para compreender os tópicos que serão abordados, você deverá considerar a produção da amônia (). Ela é um composto químico essencial em diversas indústrias e aplicações, incluindo fertilizantes, produtos químicos, refrigeração e tratamento de água, devido à sua versatilidade e importância econômica. A amônia () é produzida principalmente pelo processo Haber-Bosch, onde nitrogênio () do ar é combinado com hidrogênio (), obtido a partir de fontes de gás natural ou hidrocarbonetos, sob alta pressão e temperatura em presença de um catalisador de ferro. Outro método comum é a síntese de amônia a partir da decomposição térmica de compostos de amônio, como ureia, ou a partir da reação entre nitrogênio e hidrogênio em plasma. Esses processos são cruciais para a produção em larga escala de amônia, um composto fundamental em várias indústrias. Considere a equação balanceada de produção de amônia apresentada a seguir:
Se utilizarmos 70 g de nitrogênio e 18 g de hidrogênio, todo hidrogênio ou todo o nitrogênio irá reagir? Quanto de amônia será obtido? Bons estudos!
Vamos Começar!
Estudante, o que é uma reação química e qual é a sua importância? Para iniciar, vamos definir uma equação química, é ela que descreve a transformação de reagentes em produtos, nela você deve descrever o estado de cada um dos envolvidos, assim como a quantidade de substâncias envolvidas nesta equação.
Quando Antonie Laurente de Lavoisier (1743-1794) começou a pesar os reagentes, a química passou a ter uma relevância científica e não apenas especulativa (KOTZ et al, 2014). Um de seus estudos diz que a quantidade de massa dos produtos deve ser igual à quantidade de massa dos reagentes, sendo considerada uma reação química em sistema fechado. Esta ficou conhecida como a lei da conservação de massas. Pelo ponto de vista atômico, esta afirmação consiste em dizer que os átomos que se encontram nos reagentes devem estar contidos nos produtos, em número e tipo (exceto em reações nucleares).
Entre as descobertas da química, Dalton definiu um elemento químico como uma unidade que repetia sua massa constantemente. Seu contemporâneo, Joseph Louis Prost (1754-1826), ao trabalhar com minerais, fez uma observação bastante semelhante, porém, envolvendo moléculas: compostos purificados contêm sempre os mesmos elementos na mesma razão entre as massas. Dizer que uma molécula de água será sempre composta por dois átomos de hidrogênio e um de oxigênio, mantendo fixa a proporção de massa, ficou conhecido como lei das proporções definidas.
Na reação de formação da amônia, um composto bastante empregado na indústria de fertilizantes. Sua produção, via síntese de Haber-Bosch, ocorre pela reação do gás nitrogênio com o gás hidrogênio. Se você analisar a reação, irá observar que uma molécula do gás nitrogênio reage com três moléculas do gás hidrogênio, formando duas moléculas de amônia, ou ainda, que dois átomos de nitrogênio reagem com seis átomos de hidrogênio, formando duas moléculas de amônia, cada uma delas composta por um nitrogênio e três hidrogênios.
Note que nesta equação temos a mesma quantidade de átomos de nitrogênio e hidrogênio nos reagentes e nos produtos, então, podemos chamá-la de equação balanceada.
O hexafluoreto de enxofre é utilizado como gás inerte principalmente na indústria de eletrônicos. Sua obtenção é realizada pela queima de enxofre com gás flúor:
Para sabermos quantas moléculas do gás flúor reagem, precisamos analisar a equação inteira. Note que o gás enxofre apresenta em sua fórmula oito átomos e que são formadas oito moléculas de hexafluoreto de enxofre. Cada molécula de hexafluoreto de enxofre tem seis átomos de flúor, 48 átomos de enxofre no total. Para que esta reação ocorra, nos reagentes precisamos ter também 48 átomos de flúor. Como cada molécula de gás flúor possui 2 átomos, precisamos de 24 moléculas de gás flúor para que a reação ocorra.
O método que realizamos para encontrar a quantidade de moléculas do gás flúor foi contarmos os átomos dos dois lados, reagentes e produtos. Neste caso é bastante simples, pois dois reagentes ( e ) formam um único produto (). Quando temos uma reação de queima de combustível (como o octano – presente na gasolina), em que dois reagentes levam a dois produtos, o balanceamento é mais complicado. Para a combustão do octano, temos a reação a seguir, já balanceada.
As reações de combustão envolvem a queima de um combustível na presença de oxigênio (comburente), levando à formação de um composto contendo oxigênio (para o octano temos o gás carbônico) e água.
Para balancear uma equação química, utiliza-se o método da tentativa e erro. Sendo que alguns passos tornam o processo mais assertivo. Para reações de combustão, você pode seguir os seguintes passos:
- Escreva corretamente a fórmula dos compostos (reagentes e produtos).
- Inicie pelo elemento que formará o óxido, depois pelos átomos de hidrogênio e, então, oxigênio.
- Confira se os elementos envolvidos estão no mesmo número de átomos dos dois lados da equação.
Siga em Frente...
Exemplificando
Para a combustão do propano, temos:
Seguindo, devemos primeiro balancear os átomos de carbono, seguido dos átomos de hidrogênio e, então, oxigênio:
Carbono:
Hidrogênio:
Oxigênio:
Agora, conte os átomos:
Reagentes: 3 C, 8 H e 10 O
Produtos: 3 C, 8 H e 6+4 O
A reação balanceada está correta:
Os índices em frente a cada um dos reagentes são chamados coeficientes estequiométricos.
Quando, durante o processo de balanceamento, tivermos um número ímpar de átomos de um lado e par de outro, para darmos continuidade no processo, devemos multiplicar os átomos do lado ímpar por dois e repetir o balanceamento.
Para facilitar o balanceamento de equações, você deve começar pelo átomo que aparece em menor número de compostos. Se mais de um átomo aparece apenas uma vez, ou se todos aparecem mais de uma vez, comece pelo que tem maior número de átomos.
Começamos a aula falando da observação de Lavoisier, obtida em seus experimentos sobre o oxigênio. Até agora pensamos na conservação mais como número de átomos do que como massa.
Ao analisarmos a massa, chegamos à mesma conclusão que ao responder a situação anterior. Utilizando uma equação química balanceada, a lei da conservação das massas e a lei da proporcionalidade, você pode realizar vários cálculos, que são chamados de cálculos estequiométricos.
Com eles, podemos saber quanto de reagentes leva a quanto de produtos em termos de massa, ou quantos mols de um produto podem ser obtidos a partir dos reagentes utilizados. Podemos, também, transformar estas massas em volume. Para gases, sabemos que um mol de qualquer gás ideal nas condições normais de temperatura e pressão (CNTP) é igual a 22,4 L. Para líquidos, podemos relacionar massa e volume utilizando a densidade (, em que é densidade, a massa em gramas e o volume).
Até o momento, vimos reações em que os reagentes eram colocados na proporção exata de reagir. A partir da equação balanceada para a combustão do álcool etanol, temos exatos 1 mol de etanol para 3 mols de oxigênio. Esta relação é chamada proporção estequiométrica e define um caso em que todos os reagentes são consumidos. Entretanto, podemos ter uma situação em que as quantidades de mols de um reagente não respeitam a proporção estequiométrica. Ainda utilizando a equação de combustão do álcool como exemplo, isso significa ter na reação 1 mol de etanol e 5 mols de oxigênio. O reagente utilizado em menor proporção será totalmente consumido, sendo denominado reagente limitante. Já o reagente utilizado em excesso irá sobrar, sendo denominado reagente em excesso.
O reagente limitante define a extensão da reação, ou seja, quanto de produto irá ser formado. Você deve estar se perguntando por que colocar um dos reagentes em excesso em relação ao outro, a resposta pode envolver diversos fatores como o preço de um dos reagentes ser muito elevado com relação ao outro, portanto, não podemos ter nenhum tipo de perda. Outra razão é a purificação do produto, o reagente em excesso pode ser facilmente removido do meio reacional, facilitando a obtenção do produto em sua forma pura.
Quando utilizamos reagentes químicos, você deve ficar atento a seu grau de pureza. Se você estiver tentando usar a hematita () como fonte de ferro, deve ficar atento que a pureza dela comumente extraída no Brasil é de 85% (MAIA, 2010), ou seja, em gramas, se 100 g de minério for utilizado, apenas 85g é de hematita realmente.
A pureza de um composto comercial é obtida no rótulo de um produto, para produtos obtidos em laboratório, deve ser medida utilizando diversos equipamentos.
Até agora, você estava considerando que uma reação ocorre envolvendo a completa transformação dos reagentes em produtos, o chamado rendimento teórico. Porém, ao realizarmos uma reação na bancada, observamos que nem todo regente se transforma em produto, sendo que a quantidade de produto obtida é o rendimento real da reação. Os rendimentos teóricos e reais podem ser calculados utilizando a massa, o mol ou o volume do produto obtido.
O rendimento percentual é obtido quando dividimos o rendimento real pelo teórico, multiplicando por 100. Lembre-se de que esta fórmula pode ser substituída por uma regra de três simples.
Exemplificando
Quando você usa fermento químico em bolo, você está realizando a decomposição de bicarbonato de sódio pelo calor, produzindo carbonato de sódio, gás carbônico e água. O gás carbônico é responsável por fazer a massa do bolo crescer, conforme a reação química balanceada:
Se a reação ocorre com 85% de rendimento, quanto de será obtido na decomposição de 2g de bicarbonato de sódio?
Para resolvermos este cálculo, precisamos focar na relação de conversão entre bicarbonato e gás carbônico, construindo um quadro de relação estequiométrica de massa.
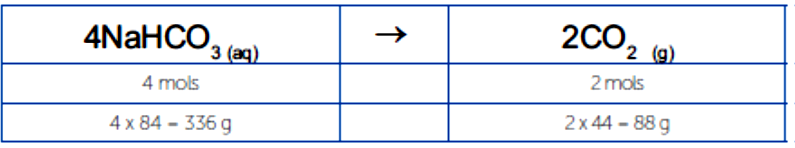
Sabemos que 336g de produzem 88 g de . Ao considerarmos os 2g, podemos calcular o rendimento teórico.
Considerando um rendimento teórico de 100%, serão produzidos 0,5245g de . Entretanto, o rendimento é de 85%, logo, temos que calcular quanto de massa será obtido tendo este rendimento.
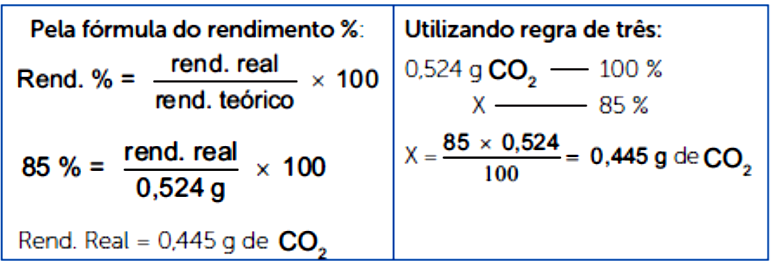
Como é um gás, melhor expressar quanto é obtido em volume. 1 mol de tem de volume, para sabermos quanto foi obtido nesta reação em volume, precisamos saber a quantos mols correspondem 0,445g.

Vamos Exercitar?
Estudante, após compreender o processo de balanceamento de equações, conhecer e aplicar os procedimentos estequiométricos com a determinação do reagente limitante e do reagente em excesso, e conhecer a forma de realização do cálculo do rendimento real de reação química, é importante realizar a interpretação e a aplicação destes conteúdos, que são fundamentais na química e necessários quando se realizam pesquisas visando obter novos produtos.
Deste modo, vamos pensar na obtenção da amônia. Se utilizarmos 70g de nitrogênio e 18g de hidrogênio, todo hidrogênio ou todo o nitrogênio irá reagir? Quanto de amônia será obtido?
Inicialmente, vamos verificar qual é o reagente em excesso e qual é o reagente limitante. Para isso, vamos elaborar verificar a conversão de massa e mols.
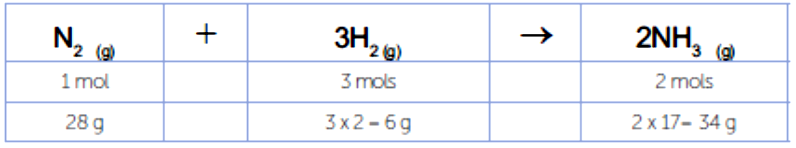
Sabemos que 28g de nitrogênio reagem com 6g de hidrogênio. Para saber qual o reagente limitante, você pode utilizar a massa de nitrogênio ou de hidrogênio:
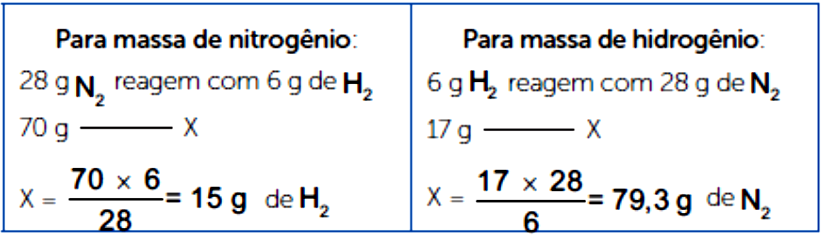
Pela massa de nitrogênio, vemos que temos hidrogênio em excesso na reação (17g, sendo necessários 15g). Pela massa de hidrogênio, temos que seriam necessários 79,3g de nitrogênio para que a reação ocorresse.
Logo, hidrogênio é reagente em excesso e nitrogênio é o reagente limitante.
Para calcular a massa de amônia obtida, devemos sempre utilizar o reagente limitante, o nitrogênio. Como 28g de nitrogênio formam 34g de amônia, podemos fazer outra regra de 3:
Portanto, em uma reação com 70g de nitrogênio e 17g de hidrogênio, serão obtidas 85g de amônia, sobrando 2g de hidrogênio.
Com isso, você conseguiu avaliar as determinar as quantidades envolvidas no processo e verificar uma aplicação específica dos tópicos abordados. Além dessa solução, você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre o balanceamento de equações químicas, acesse a biblioteca virtual e faça a leitura do capítulo 3, MOL e Estequiometria, do Livro: Química – A natureza molecular da matéria, v. 1, disponível na Minha Biblioteca.
JESPERSEN, Neil D.; HYSLOP, Alison. Química - A Natureza Molecular da Matéria - Vol. 1, 7ª edição. Rio de Janeiro: Grupo GEN, 2017. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788521633969/. Acesso em: 05 fev. 2024.
Para compreender e aprofundar seus conhecimentos sobre reagente limitante e em excesso, faça a leitura do texto: “Reagente limitante”, disponível em: http://doi.org/10.24927/rce2015.184. Acesso em: 05 fev. 2024.
Por fim, aprofunde seus conhecimentos sobre estequiometria, por meio da leitura do artigo “Estequiometria”, disponível em: http://doi.org/10.24927/rce2014.312. Acesso em: 05 fev. 2024.
Referências Bibliográficas
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
KOTZ, J. C. et al. Química geral e reações químicas. 2. ed. São Paulo: Cengage Learning, 2014. v. 1.
MAIA, D. J.; BIANCHI, J. C. de A. Química geral e fundamentos. São Paulo: Pearson Prentice Hall, 2007.
Aula 4
Reações em Solução Aquosa
Reações em Solução Aquosa
Olá, estudante! Nesta videoaula você irá conhecer os conceitos de concentração de soluções, de propriedades de soluções e sobre as reações que ocorrem em solução aquosa, como as reações de precipitação e oxidação. Esse conteúdo é importante pois ele é fundamental na química, possibilitando a dissolução e a interação de substâncias, facilitando a análise química, a produção de produtos químicos e farmacêuticos, além de desempenharem um papel vital em processos biológicos, como a digestão e o metabolismo. Esteja pronto para embarcar nesta jornada de aprendizado! Vamos lá!!!
Ponto de Partida
Olá, estudante! Por que as soluções são tão importantes na química? Neste fascinante tema, mergulharemos nas profundezas das soluções aquosas e exploraremos uma variedade de fenômenos químicos. Você vai descobrir como determinar a concentração e molaridade das soluções, essenciais para entender a quantidade de soluto presente em uma determinada quantidade de solvente. Você vai investigar o equilíbrio químico, um conceito fundamental que governa o comportamento das reações em solução aquosa. Exploraremos as reações de neutralização, que ocorrem quando ácidos e bases se combinam para formar água e um sal. Você vai explorar o mundo das reações de precipitação, onde compostos insolúveis são formados a partir da mistura de soluções aquosas. E por fim, desvendará as complexidades das reações de oxirredução, onde ocorre transferência de elétrons entre espécies químicas.
Para aplicar esses conteúdos, vamos focar nos óxidos de cálcio. Ele também é conhecido como cal viva, é um composto químico de fórmula . Ele é obtido pela calcinação do calcário, um processo que envolve aquecer o carbonato de cálcio a altas temperaturas. O óxido de cálcio é amplamente utilizado na indústria, agricultura e construção. Na construção civil, é empregado na fabricação de argamassas e concretos. Na agricultura, é utilizado para corrigir a acidez do solo e como dessecante. Além disso, é empregado na produção de papel, na síntese de produtos químicos e como agente desinfetante. Além dessas aplicações, ele também é bastante utilizado no controle da poluição, sendo amplamente aplicados na remoção de compostos de enxofre em filtros industriais (KOTZ et al, 2014). Em uma determinada aplicação, você precisa neutralizar 1,4 mols de ácido sulfúrico. Deste modo, quantos mL de uma solução 0,7M de hidróxido de cálcio são necessários para neutralizar o ácido sulfúrico?
Prepare-se para uma jornada emocionante rumo ao entendimento desses fenômenos químicos cruciais em soluções aquosas! Bons estudos!
Vamos Começar!
Estudante, a estequiometria de uma reação é importante, entretanto, nem sempre o valor de mols envolvidos em uma equação é descrito de maneira direta. Isto porque comumente soluções são utilizadas para montar uma reação química. O uso de soluções ocorre para que você possa utilizar quantidades muito pequenas de um composto, como pesar de , ou ainda, para evitar que uma reação ocorra de maneira violenta, ou seja, evitar que reações que liberam energia ocorram em grande extensão.
Pense no que ocorreria se reagíssemos um pedaço de sódio do tamanho de com água e um de ? O primeiro irá reagir, liberando uma fumaça, talvez uma breve chama, o segundo, reagiria mais violentamente, com grande potencial de provocar um acidente.
Por serem bastante usuais em química, conhecer diferentes maneiras de definir a concentração de uma solução pode ajudar muito o dia a dia de um profissional. Quando escrevemos uma equação química, colocamos o estado de cada reagente, sólido, líquido e gasoso, e ainda descrevemos se está em solução. Para muitos processos, solução aquosa é a mais comum, porém temos ainda soluções gás/gás (como o ar que respiramos), gás/líquido (como os refrigerantes), líquido/líquido (etanol em água, como o álcool comercial vendido nos supermercados), sólido/líquido (como o preparo de uma salmoura), gás/sólido ( em platina), líquido/sólido (mercúrio em ouro) e sólido dissolvido em sólido (como nas ligas metálicas, como no ouro 18 quilates que é formado por 75% de ouro puro + 25% de prata e cobre em mesma quantidade).
Para soluções, o composto que se encontra em maior quantidade é o solvente, enquanto o soluto está em menor quantidade. O solvente é a espécie capaz de separar as moléculas de soluto, impedindo sua agregação que leva à formação de outra fase. Você precisa pensar que não é em todas as soluções que o solvente é líquido, sendo que o estado físico do solvente irá definir se você está tratando de uma solução líquida, sólida ou gasosa. A água é o solvente líquido mais conhecido, denominado como solvente universal, sendo que quando tratamos de reações líquidas em água, falamos sempre em soluções aquosas.
A solubilidade de determinado soluto na solução define a quantidade máxima deste componente, sem que haja separação de fases em determinada temperatura e pressão. Para soluções aquosas, algumas notações de concentração são bastante usuais, como a concentração em massa de soluto por volume de solução:
A relação entre massa e mol deve estar clara para você, sendo assim, também podemos descrever a relação de concentração como , que leva o nome de molaridade e é uma das descrições de concentração mais utilizadas. A molaridade é dada pela razão entre o número de mols () e o volume () em litros e é representada pela expressão:
no entanto, também pode ser aplicada a regra de três.
O que acontece se pegarmos 100mL de uma solução 2M e acrescentarmos 100mL de água? Uma solução 2M possui dois mols em 1L de solução, portanto, 0,2 mol em 100mL. Se adicionarmos mais 100 mL, o novo volume da solução passa a ser 200mL. Não foi alterada a quantidade de soluto, então, ainda temos 0,2 mol, agora em 200mL e pela fórmula de molaridade, temos que a nova concentração é 1M, ou seja, ao dobrar o volume, você está reduzindo a concentração pela metade, realizando uma diluição. Se você isolar o número de mols do soluto na fórmula da molaridade terá permanece constante em uma diluição, podemos dizer que o produto do volume pela molaridade da situação inicial deve ser igual ao produto da molaridade e volumes após a alteração. Agora, se você mantiver o volume constante e alterar o número de mols, terá uma outra relação envolvendo a situação inicial e final, isto consiste em adicionar mais soluto à solução e está concentrando e não diluindo. Você também pode ter a mesma molaridade em soluções preparadas com volume e números de mols diferentes. As mesmas relações valem para concentração em g/L.
Outra situação para aumentar a concentração de uma solução, além de adicionar mais soluto, como mencionado, é realizar a evaporação do solvente, reduzindo o volume da solução. Agora que você já consegue descrever corretamente concentrações de soluções, podemos avançar em nosso estudo de soluções aquosas. Vamos começar com uma situação simples, dissolução de um sal em água. A solubilidade do é de 36g, ou seja, essa é a quantidade máxima deste sal solúvel em 100mL de água e, agora, vamos entender o que isso significa. Se adicionarmos 1g de sal em 100mL de água, ele será solubilizado, tendo assim, uma solução insaturada.
Se adicionarmos 37g de , 1g permanecerá precipitado, tendo então, uma solução saturada. Lembre-se de que a solubilidade depende da temperatura, então, se aquecermos esta solução com 37g de NaCl, atingiremos uma temperatura em que teremos uma solução novamente, ao baixarmos a temperatura a , ainda se tem uma solução, porém instável (já que está acima do seu ponto de saturação), sendo assim supersaturada. Escrevendo a equação de solubilidade do NaCl temos:
Este processo está em equilíbrio, ou seja, depois de um determinado tempo, para que novas moléculas de sal se dissociem, novas moléculas devem se associar, formando mais sólido. Para o sódio, o equilíbrio é atingido com a adição de 36g de sal em 100mL de água. Quando uma determinada reação química está em equilíbrio, a relação entre as concentrações de produtos e reagentes é dada através da constante de equilíbrio. Em uma determinada reação em que: , temos a constante de equilíbrio () calculada por:
A constante de equilíbrio pode ser calculada na solubilização de sais como o cloreto de sódio (), que é um sal bastante solúvel, e para os sólidos iônicos que apresentam pouca solubilidade. O brometo de prata (), por exemplo, é um sólido pouco solúvel e, neste caso, o equilíbrio é rapidamente atingido. Quando se atinge o máximo de íons prata e brometo na solução, temos a condição de uma solução saturada. Experimentalmente, as concentrações de íons prata em solução foram determinadas como sendo , a . Você deve notar que devido à estequiometria da equação, a cada íon prata temos um íon brometo, portanto, a concentração de brometo em uma solução de é idêntica a , logo, a .
A multiplicação das duas concentrações nos dá a constante do produto de solubilidade (), no caso do brometo de prata esta constante é dada por , a . Esta é a mesma fórmula do equilíbrio químico, entretanto, como a concentração de um sólido pouco solúvel é sempre muito maior que a concentração dos íons, os reagentes são omitidos da equação. Os valores dos produtos de solubilidade são tabelados e encontrados nos livros didáticos.
Você já pensou no que ocorre quando misturamos duas soluções de espécies bastante solúveis, como o e o ? Passamos a ter os dois cátions e os dois ânions em solução, entretanto, quando está em solução com , ocorre a formação de cloreto de prata, um sólido pouco solúvel. Visualmente, teremos a formação deste sal como um sólido, sendo está uma reação de precipitação.
Assim como o processo de solubilização, muitas outras reações químicas são reversíveis e atingem o equilíbrio, como a autoionização da água. Neste caso, uma constante de equilíbrio também pode ser calculada omitindo a concentração de água que não se dissocia, já que é muito elevada com relação à concentração dos íons gerados no processo, levando assim a uma constante de equilíbrio chamada de constante de dissociação da água .
A água neutra tem a mesma concentração de ânions hidroxila e cátions hidrônio. Neste caso, . Tendo como , em uma solução neutra é 7. À medida que perturbamos o equilíbrio, adicionando mais na água, fazemos com que estes íons hidrônio em excesso reajam com os íons hidróxido, formando mais moléculas de água. Este processo afeta o equilíbrio e deixa a concentração de maior, ou seja, menor que 7.
O pH é um conceito utilizado apenas para soluções aquosas e sua variação ocorre entre 0 e 14, pois a concentração máxima de é e a mínima é . Isto ocorre porque é sempre o mesmo a uma mesma temperatura, o que varia são as concentrações de e . Desta forma, a escala de varia de 1 a 14 e o mesmo acontece para a escala de (), sendo que a soma de e deve ser sempre 14.
Como a água, outras espécies se dissociam liberando ou , elas são respectivamente, os ácidos e bases de Arrhenius. Quando uma espécie ácida ou básica se encontra totalmente dissociada em água, temos um ácido ou uma base forte, sendo que a reação entre os dois resulta em um neutro, ou seja, ocorre uma reação de neutralização. Portanto, você pode escrever a reação entre na forma de seus íons, ou como as espécies iônicas (a fim de facilitar a representação, mostraremos os íons , porém, lembre-se de que eles sempre estarão associados a uma molécula de água como ):
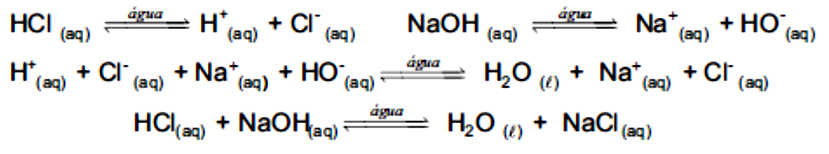
Para sabermos quando a neutralização será completa, temos que observar a estequiometria da equação, por exemplo, 1 mol de reage com 1 mol de , ou seja, para você neutralizar uma solução 1 M de , precisamos da mesma quantia de uma solução 1 M de .
O ácido acético é um ácido que, ao contrário do HCl, não se encontra totalmente dissociado em água, apenas algumas moléculas de ácido se dissociam e formam os íons em solução. Entretanto, quando reagimos este ácido fraco com uma base forte, a reação ocorre totalmente, como na reação entre ácido acético e carbonato de cálcio.
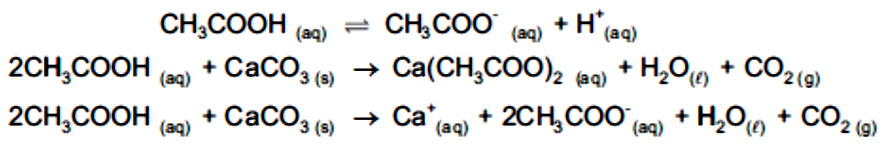
Note que carbonato de cálcio é um sólido insolúvel, portanto, não se dissocia em água, já o produto da reação é um sólido solúvel e isso deve ser levado em conta quando você escreve a equação.
Siga em Frente...
Algumas espécies, como a amônia (), não liberam quando dissociadas em água, porém atuam como bases, neste caso, estas espécies que têm a característica de se ligar a hidrogênios são classificadas como bases de BrØnsted-Lowry. Nesta classificação, ácidos são espécies que liberam cátions hidrogênio. Por ser uma base, a amônia reage com ácido clorídrico, formando o sal cloreto de amônio: . Mesmo sendo uma base fraca, a amônia reage completamente com , pois este é um ácido forte.
A força motriz em uma reação de precipitação é a formação do sólido insolúvel de uma reação ácido base em água, é a transferência de íons hidrônio. Existe ainda um terceiro tipo de reação aquosa que veremos nesta seção, a reação de oxirredução, cuja força motriz é a transferência de elétrons.
A formação de ferro metálico é um exemplo de reação de oxirredução bastante interessante, partindo do minério óxido de ferro, em reação com , é obtido ferro metálico e gás carbônico: . O óxido de ferro perde oxigênio, portanto, é reduzido, enquanto a outra espécie ganha oxigênio e é oxidada. Nem toda reação de oxirredução envolve oxigênio, mas todas envolvem o movimento de elétrons.
Quando uma espécie recebe elétrons, dizemos que ela é reduzida, pois há uma redução na carga positiva, já uma espécie que perde elétrons é oxidada. Veja a reação entre íons prata e cobre metálico , as duas semirreações são e . Na primeira semirreação, os íons recebem elétrons formando prata metálica (estado de oxidação 0). Para o cobre, na segunda semirreação, você observa que ele perde elétrons para o meio. O cobre que doa elétrons é chamado agente redutor, a prata que recebe elétrons é chamada agente oxidante. Você deve sempre lembrar que para uma espécie ser oxidada, outra deverá ser sempre reduzida.
O balanceamento de equações de oxirredução deve ser feito levando em conta o movimento de elétrons, note que nas semiequações, a prata recebe apenas um elétron por átomo, enquanto o cobre transfere dois elétrons. Desta forma, a equação final deve ter dois mols de prata reagindo com um mol de cobre. De maneira geral, o balanceamento destas equações deve seguir a regra de transferência de elétrons descrita na Figura 2.6.

A variação de carga negativa ou positiva de um átomo é chamada de número de oxidação (NOX), e é importante que você entenda que o número de oxidação de um determinado elemento ou substância simples é zero. Como substâncias simples são formadas por átomos de um único elemento, não há diferença de eletronegatividade, portanto, os átomos não ganham nem perdem carga. Para espécies monoatômicas, o número de oxidação é igual à carga do íon, elementos do grupo 1 tendem a perder um elétron, do grupo 2, dois elétrons, já o alumínio, elemento do grupo 13, tende a perder três elétrons.
Para os halogênios, o flúor (halogênio mais eletronegativo) apresenta sempre NOX igual -1. O bromo, cloro e iodo também apresentam NOX igual -1, exceto quando combinados com átomos de oxigênio e flúor. Já para o hidrogênio e oxigênio, os números de oxidação são comumente iguais a +1 e -2, respectivamente.
Algumas reações de oxirredução são espontâneas, como o processo de ferrugem. A reação entre zinco e cobre também ocorre espontaneamente, como ao colocarmos uma placa de zinco em uma solução de cobre. Como os íons cobre recebem elétrons dos átomos de zinco, ocorre o depósito de cobre (sólido vermelho) sobre a placa de zinco com o passar o tempo. Isso acarreta a alteração da cor da solução, antes azul, devido à presença de cátions cobre.
Este processo gera energia, e embora a reação seja espontânea, a energia não está sendo aproveitada. Para que isso ocorra, é necessário montar uma pilha, como a pilha de Daniel. Em uma pilha, as reações devem ocorrem em recipientes separados, assim, elétrons provenientes da reação circulam por um fio externo, realizando trabalho elétrico. Em uma pilha, com o passar do tempo, a concentração de cargas negativas (na redução) ou positivas (na oxidação) aumenta, sendo que a ponte salina tem como função equilibrar estas cargas com o deslocamento de cátions e ânions para as soluções deficientes em carga positivas ou negativas, respectivamente.
Em uma pilha, o ânodo é onde ocorre a semirreação de oxidação e o cátodo é onde ocorre a semirreação de redução. Para sabermos se uma reação é espontânea ou não, devemos consultar seus potenciais padrões de redução, eles nos indicam qual a tendência em espécies serem oxidadas ou reduzidas, sendo que quanto mais positivo este valor, maior a tendência de a semirreação ocorrer como está escrita. Estes valores são tabelados.
Vamos Exercitar?
Estudante, após conhecer e compreender as características das reações que se processam em solução aquosa, assim como os conceitos de concentração e molaridade, reações de neutralização, precipitação e oxirredução, agora você precisa colocar em prática esses conhecimentos. Para isso, vamos pensar em uma situação em que é precisa realizar a neutralização de uma quantidade de ácido sulfúrico empregando hidróxido de cálcio em um sistema voltado ao controle ambiental de um processo.
Em uma determinada aplicação, você precisa neutralizar 1,4 mols de ácido sulfúrico. Deste modo, quantos mL de uma solução 0,7M de hidróxido de cálcio são necessários para neutralizar o ácido sulfúrico?
Analisando a equação, temos:
Para neutralizar 1,4 mols de ácido, precisamos de 1,4 mol de base, pois temos uma estequiometria 1:1 entre o ácido sulfúrico e o hidróxido de cálcio. Desse modo, se temos uma solução 0,7 M de base, temos 0,7 mol em 1 L, portanto precisaremos de 2 L da solução.
Com isso, você conseguiu aplicar os conceitos da reações em solução aquosa para solucionar um problema do cotidiano relacionado as reações químicas que estão presentes em diferentes processos do nosso dia a dia. Além dessa solução, você pode pensar em pontos extras e adicionais sobre o problema apresentado. Continue estudando!
Saiba Mais
Para saber mais sobre as reações em solução aquosa, acesse a biblioteca virtual e faça a leitura do capítulo 4, Reações em solução aquosa, do livro “Química”, disponível na Minha Biblioteca.
CHANG, Raymond; GOLDSBY, Kenneth A. Química. Porto Alegre: Grupo A, 2013. Disponível em: https://integrada.minhabiblioteca.com.br/#/books/9788580552560/. Acesso em: 06 fev. 2024.
Para compreender e aprofundar seus conhecimentos as reações de neutralização, faça a leitura do artigo: “Reações ácido-base: conceito, representação e generalização a partir das energias envolvidas nas transformações”, disponível em: https://doi.org/10.1590/S0100-40422012001000031. Acesso em: 06 fev. 2024.
Por fim, aprofunde seus conhecimentos sobre as reações de precipitação, por meio da leitura do artigo “Química analítica básica: as reações de precipitação”, disponível em: https://doi.org/10.20396/chemkeys.v4i00.16099. Acesso em: 06 fev. 2024.
Referências Bibliográficas
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
ZUMDAHL, Steven S.; DECOSTE, Donald J. Introdução à química: fundamentos. 8. ed. São Paulo: Cengage Learning, 2016.
Encerramento da Unidade
Fundamentos da Química Geral e Estequiometria
Videoaula de Encerramento
Olá, estudante! Nesta videoaula você irá rever as definições de compostos iônicos e moleculares, de mol e relações estequiométricas, irá trabalhar com os diferentes tipos de reações químicas e realizar o balanceamento de equações químicas, por fim, irá trabalhar com as reações em solução aquosa. Esse conteúdo é importante para a sua prática profissional, pois as habilidades adquiridas são essenciais para entender como as substâncias interagem e se transformam. Esteja pronto para embarcar nesta jornada de aprendizado! Vamos lá!
Ponto de Chegada
Olá, estudante! Para desenvolver a competência desta Unidade, que é conhecer e compreender os fundamentos das reações químicas, os balanceamentos de reações e a estequiometria envolvendo as transformações da matéria você deverá primeiramente conhecer e trabalhar com as definições de compostos iônicos e moleculares. A definição desses compostos é fundamental para compreender o comportamento das substâncias frente a diferentes tipos de reações, mas além disso, você precisa conhecer o conceito de quantidade de matéria e a definição de mol, além de realizar os cálculos relativos à determinação da quantidade de matéria envolvida em uma reação química.
As transformações da matéria são representadas pelas reações químicas, a qual você deve representar adequadamente por meio das equações químicas, além disso, deve obedecer a lei de conservação das massas e a lei das proporções constantes, realizando o balanceamento de equações pelo método das tentativas. Ao realizar uma reação química, é preciso saber quais são os reagentes envolvidos e os produtos que são formados, desse modo, você precisa trabalhar com os diferentes tipos de reações, como as de síntese, decomposição, simples troca e dupla troca. Além disso, você deve saber as quantidades envolvidas na transformação da matéria, sendo que muitas vezes as reações ocorrem com rendimento máximo, mas em muitas situações, é preciso trabalhar com quantidades distintas as relações estequiométricas visando o máximo rendimento, desse modo, você precisa determinar o reagente limitante e o reagente em excesso.
Por fim, você precisa considerar que em muitas situações o meio pode influenciar nas transformações da matéria, desse modo, você deve explorar os conceitos das reações em solução aquosa, sabendo identificar as características de uma solução, o que é o soluto e solvente, quais são as formas de expressão de suas concentrações e molaridade. Além disso, preciso conhecer os principais tipos de reações que podem ocorrer, como as reações de neutralização, as reações de precipitação e as reações de oxirredução. Afinal, química não consiste apenas em misturar reagentes de qualquer maneira.
É Hora de Praticar!
Você vai se colocar no lugar de um profissional recém-contrato em uma indústria de produtos químicos que está montando uma nova linha de produção. O produto que será obtido é a soda cáustica, produzida pela hidrólise aquosa de . Sua função como químico é montar o processo calculando os reagentes envolvidos e avaliando o rendimento. Como ocorre esta reação? Antes de você responder a esta pergunta, precisa entender como se medem os reagentes químicos, como calculamos o rendimento e como vemos se a equação química está escrita corretamente. Todos estes detalhes vão significar um processo eficiente, convertido em lucro para a empresa. Desse modo, você precisa trabalhar com algumas situações específicas relacionadas ao processo em questão.
Sua primeira tarefa é saber quanto de cloreto de sódio irá produzir hidróxido de sódio. O primeiro passo é saber escrever a equação química em que o cloreto de sódio reage com a água, formando hidróxido de sódio, hidrogênio e gás cloro. Você começa a pensar em termos do processo, se reagir 250kg de , quanto de será formado? 250 Kg? Seu gestor pede uma produção inicial para um teste da planta de 100Kg de . Quanto de você deve reagir?
Seguindo a implementação do processo, é possível verificar se a equação proposta está correta? Quanto realmente produz de ? Para isso, você irá montar esta mesma reação em pequena escala em laboratório. Quanto de será obtido? Agora, deverá checar a equação química e verificar se ela está correta e se a quantidade que você previu que seria formada de realmente será obtida.
Agora você está na etapa final de implementação do processo e precisa dimensionar o reator químico e conferir se as equações utilizadas até o momento estão corretas, já que um erro na estequiometria do processo acarreta um erro de produção com grande impacto econômico.
Você já sabe qual o tipo de reação que está ocorrendo? Você consegue descrever o processo químico? Para isso, antes, será preciso calcular a concentração da solução. Como calcula-se a concentração de uma solução? Qualquer concentração é aceita em uma solução? Quais são os limites? Qual volume da solução preparada deve ser utilizado para obter a massa desejada? Qual característica o reator deve ter frente ao produto formado?
Bons estudos!
Reflita
Com o conceito de massa atômica sozinho é possível prever as quantidades envolvidas em um processo de transformação da matéria?
Ao identificar uma reação química, como podemos prever as quantidades de produtos que serão formados a partir de uma quantidade de reagente adicionada? Existe uma relação entre os átomos envolvidas e suas quantidades nesse processo?
Ao realizar uma reação química, muitas vezes empregamos soluções aquosas, qual é a finalidade de empregar soluções aquosas em diferentes tipos de reações químicas?
Resolução do estudo de caso
Você está se colocando no lugar de um profissional em uma fábrica que está iniciando um processo de eletrólise para formação de soda cáustica, o hidróxido de sódio. Para acompanhar o processo, você precisa, inicialmente, escrever a equação química. Você sabe que cloreto de sódio reage com água, formando hidróxido de sódio, gás hidrogênio e gás cloro. Então, temos algo assim:
Sua primeira tarefa é saber quanto de cloreto de sódio irá produzir hidróxido de sódio. Você desconfia que 1 mol de . Então, é preciso calcular a massa molar de cada um dos compostos:
Se garantirmos que todo cloreto de sódio será convertido em hidróxido de sódio, temos que de formam de .
Para responder ao seu gestor quanto de teremos que usar para formar de , podemos seguir dois caminhos:
1) A partir do mol: você sabe que 1 mol de tem massa molar de , então correspondem a (regra de 3).
Se 1 mol de leva a 1 mol de , para obtermos 2,5 kmol de produto, precisamos da mesma quantidade em mol de reagente.
2) A partir da massa: basta você utilizar as massas molares calculadas:
Você começou a montar seu processo, mas nem sempre temos uma conversão completa.
Dando sequência, você observou que não balanceou a equação, esta quantidade está correta? Vamos realizar o balanceamento da equação e responder a esta e a outras perguntas.
Vimos que o balanceamento de uma equação ocorre através do método da tentativa e erro. Para isso, devemos começar por um elemento que apareça menos vezes, como o sódio.
– Sódio: temos um átomo nos reagentes e um no produto, portanto, está ok.
– Cloro: temos um átomo no reagente e dois no produto, portanto, devemos alterar esta estequiometria, sendo necessário, rever o Na.
– Então, os átomos de H e O:
Conte os átomos e verifique que agora sua equação está balanceada:
Como 2 mols de produzem 2 mols de , temos que:
Mesmo resultado obtido anteriormente para uma conversão de 100%, ou seja, todo reagente se transforma em produto.
Para saber o rendimento real da equação, você pediu à equipe de laboratório que realizasse a reação em pequena escala. Os resultados que foram passados são que para reagente com 99,9% de pureza, a reação ocorreu com 83 % de rendimento, tendo o como reagente limitante, em concentração de .
Ter o como reagente limitante, significa que a água é utilizada em excesso, sendo o solvente da reação. Os cálculos devem ser sempre realizados com relação ao reagente limitante. Se o resultado do laboratório for transposto para a planta industrial, os não serão obtidos e sim a massa correspondente a deste valor, .

Portanto, para planejar seu processo você precisa aumentar a quantidade de NaCl, uma vez que a massa de de irá produzir apenas de . Portanto, levando em consideração o rendimento obtido no laboratório, temos:
Quando a equipe de laboratório enviou os resultados de rendimento, algumas informações o surpreenderam, como a concentração. O que significa esta concentração? Qual o tamanho do reator que precisa ser utilizado para utilizar 176,2kg de NaCl, mantendo esta concentração? Qual sua influência no processo? E ainda, como esta reação realmente ocorre?
Por fim, você deve analisar a equação química, qual reação ocorre? Sabemos que é uma reação aquosa, porém não há precipitação nem neutralização. Esta é uma equação de oxirredução e ocorre quando uma corrente elétrica é passada entre os elétrodos.
Você pode separar a equação principal em semiequações:
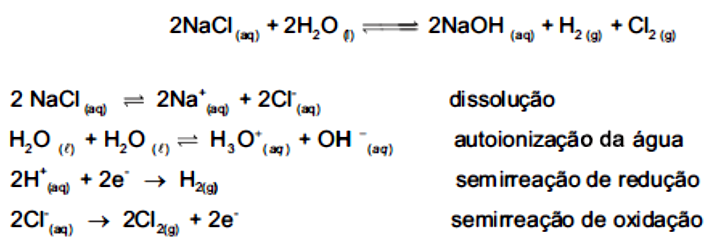
Separando todas as etapas, fica evidente que a reação é de oxirredução entre o cloro e o hidrogênio, sendo que gás cloro é formado no ânodo e o gás hidrogênio é formado no cátodo. Reações de oxirredução em meio aquoso são chamadas de eletrólise.
Com a formação dos dois gases em solução, teremos íons sódio e hidróxido que, após evaporação do solvente, levam à formação de hidróxido de sódio sólido.
Com relação à concentração, o que significa uma concentração de ?
A solubilidade máxima de é em de água. Então, para termos de em solução, devemos calcular:
Isso significa que você deve adicionar de
em de água para garantir que haja uma solução saturada, ou seja, este é o volume mínimo para solubilizar todo . Com esta massa, neste volume, teremos uma concentração de ou uma molaridade de , já que a massa molar do é .
A concentração nos deu a relação massa volume, indicando assim a quantidade de solvente a ser utilizada, . Isso define que o reator deve conter um tamanho suficiente para esta quantidade de água, mais a adição de sólidos. Para operar com segurança, devido à produção de gases, você deve requisitar um reator de, no mínimo, para realizar a reação.
E sobre as especificações do reator, além de ser antioxidante (o que garante que não ocorrerão reações paralelas de oxirredução), qual outra característica é necessária?
Para responder a esta pergunta, precisamos calcular o pH da solução após a reação, e para isso precisamos da concentração aproximada de .
Como calculado anteriormente, esta massa produzirá de (100% de rendimento), sendo a massa molar do , teremos ao final da reação de base, ou seja, de íons . Para calcularmos o volume final da solução, devemos pensar que 2500 mols de água sofreram autoionização completa, sendo que os íons hidrônio reagiram e os íons hidroxila permaneceram em solução.
Como massa molar da água é , de água autoionizaram (), dando um volume final de água de (levando em consideração que não houve evaporação da água adicionalmente).
Como temos
mols de em de água, a molaridade da solução de será 6,9 M.
Com esta concentração de íons hidróxido em solução, o equilíbrio de dissociação da água se encontra praticamente todo deslocado no sentido dos reagentes, com isso, a concentração de íons hidrônio é praticamente zero, sendo, então, pH de aproximadamente 14 unidades.
Este dado é muito importante na escolha do reator, pois a especificação do material utilizado deve ser de resistência a altamente básicos. Agora você mapeou todas as etapas do processo, calculou a massa a ser reagida visando uma quantidade de produto especificada, e com isso entendeu a importância de cálculos estequiométricos em processos químicos. Também compreendeu a reação que estava sendo realizada e conseguiu dimensionar o tamanho do reator a ser utilizado, além de algumas características.
Para finalmente implementar o processo, você deve fazer uma consulta no mercado, observando quais os reatores mais utilizados em reações de eletrólise, acertar a volumetria entre os tipos disponíveis e começar a produção. Desta forma, suas projeções deixaram seu gestor muito satisfeito.
Dê o play!
Assimile
Estudante, venha embarcar em uma jornada de descobertas fascinantes no mundo da química! Nosso estudo abrange uma ampla gama de tópicos essenciais, desde os fundamentos dos compostos iônicos e moleculares até as complexidades das reações em solução aquosa. Ao explorar os compostos iônicos, mergulharemos na compreensão das forças eletrostáticas que unem íons positivos e negativos, desvendando os segredos por trás de substâncias como sais. Entenderemos o conceito de mol, uma unidade crucial para quantificar a quantidade de substância em uma amostra, e exploraremos as relações estequiométricas, que nos permitem realizar cálculos precisos em reações químicas. Em seguida, mergulharemos nos diferentes tipos de reações químicas, desde as simples reações de adição e decomposição até as mais complexas reações de simples e dupla troca, desvendando os mistérios por trás das transformações de matéria. Aprenderemos a escrever e balancear equações químicas, habilidades essenciais para descrever as transformações que ocorrem durante as reações. Discutiremos o conceito de reagente limitante e reagente em excesso, além de explorar as fascinantes reações em solução aquosa, como as reações de neutralização, de precipitação e de oxirredução.
Explore essa empolgante jornada de aprendizado, onde você desvendará os segredos da química e sua aplicação em nosso mundo!
Referências
ATKINS, P.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman, 2009.
DREKENER, R. L. Química Geral. Londrina: Editora e Distribuidora S.A., 2017
FÁBREGA, F. M. Química Geral e Experimental. Londrina: Editora e Distribuidora Educacional S. A., 2016.
KOTZ, J. C. et al. Química geral e reações químicas.2. ed. v. 1. São Paulo: Cengage Learning, 2014.
MAIA, D. J.; BIANCHI, J. C. de A. Química geral e fundamentos. São Paulo: Pearson Prentice Hall, 2007.
RUSSEL, John B. Química geral. v. 2, 2. ed. São Paulo: Pearson Education do Brasil, 2011.
ZUMDAHL, Steven S.; DECOSTE, Donald J. Introdução à química: fundamentos. 8. ed. São Paulo: Cengage Learning, 2016.